Pravidelné vlastnosti prvkov a ich charakteristiky

- 3547
- 192
- Gabriel Bahna
Ten Pravidelné vlastnosti prvkov Sú to tí, ktorí definujú svoje fyzikálne a chemické správanie z atómového hľadiska a ktorých veľkosti okrem atómového čísla umožňujú klasifikáciu atómov.
Zo všetkých vlastností sú charakterizované, ako už názov napovedá, pretože sú pravidelné; To znamená, že ak sa študuje periodická tabuľka, je možné certifikovať, že jej veľkosť dodržiava trend, ktorý sa zhoduje s usporiadaním prvkov v obdobiach (riadky) a skupinách (stĺpce).
 Vnútorná periodicita časti prvkov periodickej tabuľky. Zdroj: Gabriel Bolívar.
Vnútorná periodicita časti prvkov periodickej tabuľky. Zdroj: Gabriel Bolívar. Napríklad, ak cestujete po periodickom období a vlastnosť klesá s veľkosťou s každým prvkom, to isté sa stane vo všetkých obdobiach. Na druhej strane, ak klesá po skupine alebo stĺpci, zvyšuje svoju veľkosť, to isté možno očakávať pre ostatné skupiny.
A tak sa ich variácie opakujú a svedčia jednoduchý trend, ktorý súhlasí s usporiadaním prvkov pre ich atómové čísla. Tieto vlastnosti sú priamo zodpovedné za kovový alebo nemetalický charakter prvkov, ako aj za ich reaktivity, čo im pomohlo klasifikovať ich s väčšou hĺbkou.
Ak na chvíľu nebola neznáma identita prvkov a boli považované za podivné „sféry“, periodickú tabuľku by sa mohla prestavať (s množstvom práce) využívať tieto vlastnosti.
Týmto spôsobom by predpokladané sféry získali farby, ktoré by im umožnili odlíšiť ich od seba v skupinách (vynikajúci obrázok). Poznanie svojich elektronických charakteristík sa mohli zorganizovať v obdobiach a skupiny by zradili tie, ktoré majú rovnaký počet valenčných elektrónov.
Pravidelné vlastnosti učenia a zdôvodňovania sa rovnajú vedieť, prečo prvky reagujú tak či onak; Vie, prečo sú kovové prvky v určitých oblastiach stola a nemetalické prvky v inom.
[TOC]
Aké sú pravidelné vlastnosti a ich vlastnosti
-Atómové rádio
Pri pozorovaní sférovacích sfér prvej veci, ktorú si môžete všimnúť, je to, že nie všetci majú rovnakú veľkosť. Niektoré sú viac objemné ako iné. Ak sa to pozoruje s väčším detailom, zistí sa, že tieto veľkosti sa líšia dodržiavaním vzoru: v období klesá zľava doprava a v skupine sa zvyšuje zhora nadol.
Vyššie uvedené sa dá povedať aj týmto spôsobom: atómový polomer klesá smerom k skupinám alebo stĺpcom vpravo a zvyšuje sa v nižších obdobiach alebo riadkoch. Atomický polomer je teda prvou periodickou vlastnosťou, pretože jej variácie sledujú vzor v rámci prvkov.
Jadrové zaťaženie vs elektróny
Aký je tento vzor? V období atómové elektróny zaberajú rovnakú úroveň energie, ktorá súvisí s vzdialenosťou, ktorá ich oddeľuje od jadra. Keď sa presunieme z jednej skupiny do druhej (ktorá je rovnaká ako cestovanie po dobu doprava), jadro pridá elektróny aj protóny v rámci rovnakej energetickej úrovne.
Môže vám slúžiť: uhlíkPreto elektróny nemôžu zaberať vzdialenosti ďalej od jadra, čo zvyšuje jeho pozitívne zaťaženie, pretože má viac protónov. V dôsledku toho elektróny zažívajú väčšiu silu príťažlivosti voči jadru a čoraz viac ich priťahujú, keď sa zvyšuje počet protónov.
Preto prvky na pravom konci periodickej tabuľky (žlté a tyrkysové stĺpce) majú menšie atómové rádiá.
Na druhej strane, keď „skočí“ z jedného obdobia na druhé (čo je rovnaké, čo hovorí, že skupina zostúpi), nové povolené hladiny energie umožňujú elektrónom zaberať vzdialenejšie priestory v jadre. Jadro (s viacerými protónmi) ich priťahuje menšou silou; A atómové rádiá sa preto zvyšujú.
Iónové rádiá
Iónové rádiá dodržiavajú vzor podobný vzoru atómových rádií; Tieto však nezávisia od jadra, ale koľko elektrónov alebo menej má atóm vzhľadom na jeho neutrálny stav.
Katióny (na+, Ac2+, Do3+, Byť2+, Vernosť3+) vykazujú pozitívne zaťaženie, pretože stratili jeden alebo viac elektrónov, a preto ich jadro priťahuje väčšou silou, pretože medzi nimi je menej odporov. Výsledok: Katióny sú menšie ako atómy, z ktorých odchádzajú.
A pre anióny (alebo2-, F-, Siež2-, Jo-) Naopak, vykazujú negatívne zaťaženie, pretože má jeden alebo viac prebytočných elektrónov, čím sa zvyšujú jeho odpudky medzi sebou nad príťažlivosťou, že jadro uplatňuje. Výsledok: Anióny sú väčšie ako atómy, z ktorých odvodzujú (nižší obrázok).
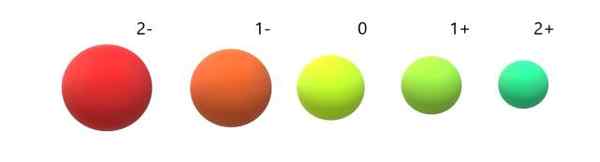 Variácia iónových rádií vzhľadom na neutrálny atóm. Zdroj: Gabriel Bolívar.
Variácia iónových rádií vzhľadom na neutrálny atóm. Zdroj: Gabriel Bolívar. Je zrejmé, že anión 2- je najjemnejší zo všetkých a katión 2+ najmenší. Rádiá sa zvyšujú, keď je atóm negatívne nabitý, a zmluvy, keď je pozitívne nabitá.
-Elektronegativita
Ak majú prvky malé atómové rádiá, nielen ich elektróny sú veľmi priťahované, ale aj elektróny susedných atómov, keď tvoria chemickú väzbu. Táto tendencia prilákať elektróny iných atómov v zlúčenine je známa ako elektronegativita.
Ten, ktorý je atóm malý, neznamená, že bude viac elektronegatív. Ak áno, prvky hélia a vodíka by boli najviac elektronegatívnymi atómami. Hélium, kde preukázala veda, nevytvára kovalentné spojenie žiadneho druhu; A vodík, sotva má jeden protón v jadre.
Môže vám slúžiť: Sulfid meďnatého: Štruktúra, vlastnosti, použitieAk sú atómové rádiá veľké, jadrá nemajú dostatočnú silu na prilákanie elektrónov iných atómov; Preto najviac elektronegatívnych prvkov sú tie, ktoré majú malý atómový polomer a väčší počet protónov.
Tí, ktorí tieto charakteristiky dokonale stretávajú, sú opäť nemetalické prvky bloku P periodickej tabuľky; Sú to tie, ktoré patria do skupiny 16 alebo kyslíka (O, S, SE, TE, PO) a skupina 17 alebo fluór (F, Cl, Br, I, AT).
Trend
Podľa všetkého, čo bolo povedané, najviac elektronegatívnych prvkov sa nachádzajú najmä v pravom hornom rohu periodickej tabuľky; Mať fluorid ako prvok, ktorý vedie zoznam najviac elektronegatívnych.
Pretože? Bez toho, aby sa uchýlili k elektronickým stupniciam (Pauling, Mulliken atď.), fluór, hoci je väčší ako neón (ušľachtilý plyn jej obdobia), prvý môže tvoriť odkazy, zatiaľ čo druhý nie. Okrem toho má pre svoju malú veľkosť jeho jadro veľa protónov a kde je fluor.
-Kovár
Ak má prvok atómový polomer v porovnaní s rovnakým obdobím a je tiež malý elektronegatívny, je to kov a má vysoký kovový charakter.
Ak sa vrátime k hlavnému obrázku, červenkasto a zelenkavé sféry, rovnako ako sivé, zodpovedajú kovovým prvkom. Kovy majú jedinečné vlastnosti a odtiaľ sa začnú prelínať periodické vlastnosti s fyzickými a makroskopickými vlastnosťami hmoty.
Prvky s vysokým kovovým charakterom sa vyznačujú ich relatívne veľkými atómami, ľahko stratia elektróny, pretože jadrá ich sotva priťahujú k nim.
V dôsledku+; To neznamená, že všetky katióny sú kovové.
Trend
V tomto bode môžete predpovedať, ako sa kovový znak v periodickej tabuľke líši. Ak je známe, že kovy majú veľké kovové rádiá a že existuje aj málo elektronegatínov, mali by sa očakávať najťažšie prvky (nižšie obdobia), byť najviac kovové; a ľahšie prvky (horné obdobia), najmenej kovové.
Podobne kovový charakter klesá, čím viac sa vyrába prvok. To znamená, že prehliadka období a skupín po pravidelnom stole v ich vyšších obdobiach splní najmenej kovové prvky.
Preto sa kovový charakter zvyšuje zostupom skupinou a v rovnakom období klesá na pravú doprava. Medzi kovovými prvkami, ktoré máme: Na (sodík), li (lítium), mg (horčík), ba (bária), Ag (strieborné), Au (zlato), PO (Polonio), Pb (olovo), CD (kadmium) ), Do (hliníka), atď.
Môže vám slúžiť: bod varu: koncept, výpočet a príklady-Ionizačná energia
Ak má atóm veľký atómový polomer, očakáva sa, že jeho jadro nedrží elektróny na značnú pevnosť vo vonkajších vrstvách. V dôsledku toho ich odstránenie z atómu v plynnej fáze (individualizovanej) nebude vyžadovať veľa energie; To je ionizačná energia, EI, ktorá je potrebná na odstránenie elektrónu.
Tiež sa rovná tvrdeniu, že je to energia, ktorá musí byť dodaná na prekonanie sily príťažlivosti jadra atómu alebo plynového iónu na jeho vonkajšom elektróne. Čím menší je atóm a viac elektronegatívne, tým nižšie je; Toto je vaša tendencia.
Príklad ilustruje nasledujúcu rovnicu:
Na (g) => na+g) + e-
Potrebné na dosiahnutie tohto cieľa nie je také veľké v porovnaní s druhou ionizáciou:
Nat+(g) => na2+g) + e-
Pretože v NA+ Prevláda pozitívne náboje a ión je menší ako neutrálny atóm. V dôsledku toho jadro NA+ priťahuje s oveľa väčšou silou na elektróny, takže vyžaduje oveľa väčšiu.
-Elektronická príbuznosť
A nakoniec, existuje pravidelná vlastnosť elektronickej afinity. Toto je energetický trend, ktorý má atóm prvku plynnej fázy na prijatie elektrónu. Ak je atóm malý a má jadro s veľkou silou príťažlivosti, bude pre vás ľahké prijať elektrón, čím sa vytvorí stabilný anión.
Čím stabilnejší je anión vzhľadom na jeho neutrálny atóm, tým väčšia je jeho elektronická afinita. Odpudky medzi rovnakými elektrónmi však prichádzajú do hry.
Napríklad dusík má väčšiu elektronickú afinitu ako kyslík. Je to preto, že ich tri elektróny 2p zmiznú a odpudzujú menej medzi sebou a prichádzajúcim elektrónom; Zatiaľ čo v kyslíku existuje pár párových elektrónov, ktoré vykazujú väčšie elektronické odpudenie; A vo fluoridu sú dva páry.
Z tohto dôvodu sa hovorí, že trend v elektronických afinitách je normalizovaný od tretieho obdobia periodickej tabuľky.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Profesor. Ortega Graciela m. (1. apríla 2014). Pravidelné vlastnosti prvkov. ABC Farba. Zdroj: ABC.com.Pych
- Chémia librettexts. (7. júna 2017). Dobové vlastnosti prvkov. Získané z: Chem.Librettexts.orgán
- HelMestine, Anne Marie, PH.D. (2. januára 2019). Pravidelné vlastnosti prvkov. Zotavené z: Thoughtco.com
- Tobolka. (s.F.). Dobové vlastnosti prvkov. Získané z: Toppr.com / com /
- Pravidelné vlastnosti prvkov: Cesta cez stôl je cesta chémiou. [PDF]. Obnovené z: COD.Edu
- « Zastarané vnímané faktory, dôsledky a príklady
- Objektívna história umenia, charakteristiky, zástupcovia a diela »

