Aufbau

- 1874
- 176
- Adrián Fajnor
 Atómové orbitály vyplňujú objednávku podľa princípu AUFBAU
Atómové orbitály vyplňujú objednávku podľa princípu AUFBAU Aký je princíp Aufbau?
On Aufbau, Tiež známe ako daždivé pravidlo alebo zásada výstavby, je to praktické pravidlo, ktoré umožňuje predpovedanie elektronickej konfigurácie prevažnej väčšiny prvkov periodickej tabuľky, ako aj konania jej iónov.
Tento princíp ustanovuje, že keď sa protóny pridávajú do jadra, jeden po druhom, aby postupne vybudoval každý chemický prvok, elektróny sa postupne pridávajú k najmenším energetickým atómovým orbitálom, ktoré sú k dispozícii.
Inými slovami, Aufbau preukázal, že existuje špecifický poriadok, podľa ktorého je možné vyplniť atómové orbitály. Táto objednávka je vysvetlená nižšie.
Poradie vyplnenia orbitálov podľa zásady aufbau
Poradie, v ktorom sú naplnené atómové orbitály, závisí od ich energetickej úrovne. Zlatým pravidlom je, že tieto hladiny energie sú naplnené od najmenej k najväčšiemu, akoby to bola budova, v ktorej by sa mali byty naplniť najnižšími podlahami, aby sa dostal k najvyšším podlahám.
V tomto zmysle, aby sme predpovedali poradie vyplnenia orbitálov, musíme najprv vedieť, ako sú objednané podľa ich energetickej úrovne. V analógii budovy to znamená vedieť, ktoré (orbitálne) apartmány sú na každom poschodí.
Nasledujúca grafika ukazuje hladinu energie prvých atómových orbitálov objednaných od najnižších po väčšiu energiu.
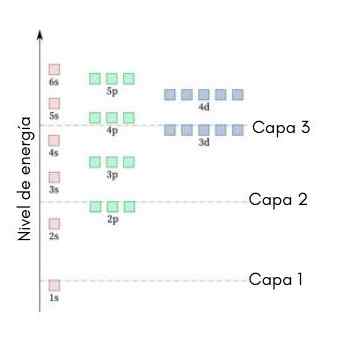
Na tomto obrázku predstavuje každý obrázok konkrétny orbitál, v ktorom sa hodia iba 2 elektróny. Každá skupina obrazov rovnakej farby predstavuje podskupinu energie.
Tieto čiastkové úrovne sú identifikované číslom a písmenom (1S, 3P, 3D atď.). Číslo označuje hlavnú úroveň energie, zatiaľ čo písmeno označuje typ orbitálu, ktorý tvorí skupinu.
Môže vám slúžiť: chlorid hliníka (ALCL3)Podľa tejto schémy je prvou úrovňou podskupiny, ktorá sa musí vyplniť.
Dážď pravidlo
Napriek tomu, aké ľahké je stanoviť poradie vyplnenia, ak máte graf, ako je ten predchádzajúci, je ťažké si zapamätať konkrétne poradie, v ktorom idú rôzne čiastkové úrovne. Na tento účel sa používa niektorí z nich „pravidlo dažďa“.
Toto pravidlo pozostáva z dvoch jednoduchých krokov:
Krok 1
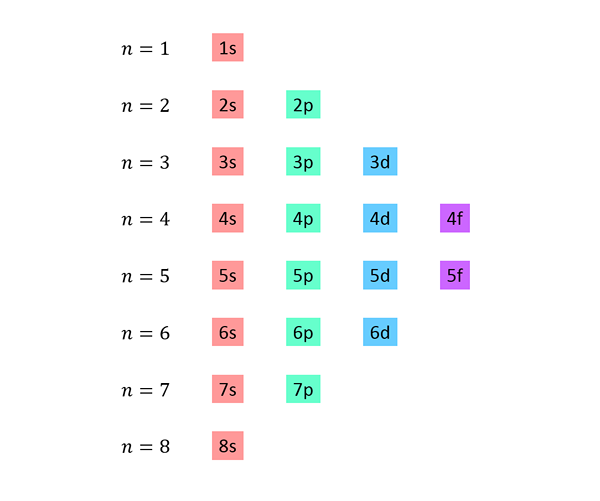
Vytvorí sa zoznam, v ktorom každá čiara zodpovedá energetickej úrovni a obsahuje jednu za druhou, všetky čiastky dostupné na tejto úrovni energie.
Napríklad prvý riadok zodpovedá úrovni 1 (n = 1) a obsahuje iba 1S sub -úroveň; Druhý riadok zodpovedá úrovni n = 2 a obsahuje 2S a 2p podsuzy; Tretí obsahuje 3S, 3p a 3D čiastkové úrovne atď.
Kompletný zoznam vyzerá takto:
Krok 2
Zostupné uhlopriečky sú nakreslené sprava doľava, jedna pod druhou, ako je znázornené nižšie.
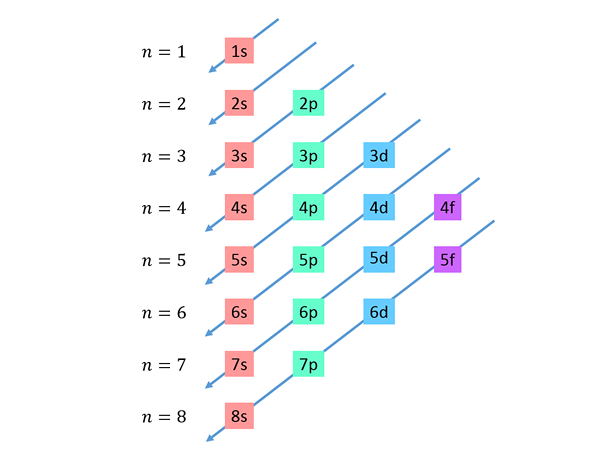
Tieto čiary pripomínajú cestu kvapiek vody počas vetra s vetrom, takže tento graf sa zvyčajne nazýva „dažďová metóda“. Poradie na vyplnenie je určené poradím, v ktorom sa tieto diagonály dotýkajú čiastkových úrovní v zozname.
Na základe predchádzajúceho obrázku je poradie energie orbitálov, a preto poradie, v ktorom musia byť vyplnené, je:
Môže vám slúžiť: kvantová tabuľka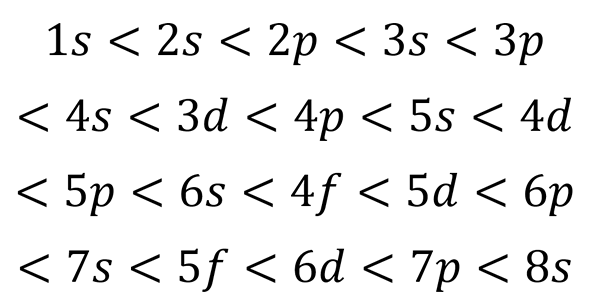
Táto objednávka na vyplnenie je jediný, na ktorom skutočne záleží pri písaní elektronickej konfigurácie atómu. Pri vyplňovaní týchto čiastkových stupňov je treba pamätať na to, že v podskupinách siež Zmestia iba 2 elektróny p fit 6, v d Sa zmestia 10 a do F Fit 14.
Výnimky na začiatku aufbau
Princíp AUFBAU jasne uvádza, že sub -úroveň nie je možné vyplniť, kým sa všetky predchádzajúce čiastkové stupne nevyplnia úplne. Existujú však určité výnimky z tohto pravidla.
V niektorých prípadoch ATOM uprednostňuje, aby mal podložku energie naplnenú presne na polovicu, ako mať neúplný, ktorý nie je plný na polovicu. V týchto prípadoch sa skutočná elektronická konfigurácia atómu nezhoduje s predpovedaným poradím pomocou metódy dažďov.
Napríklad podľa princípu AUFBAU by chrómový atóm mal mať elektronickú konfiguráciu, ktorá končí v 4S2 3D4. Jeho skutočná konfigurácia je však 4s1 3D5 pretože teda sú teda 4S a 3D čiastkové stupne vyplnené na polovicu, zatiaľ čo v inej konfigurácii č.
To isté platí pre meď, ktorej konfigurácia končí v 4S1 3D10, Namiesto 4S2 3D9, Pretože tak vyplní čiastkovú úroveň D a S sú plné na polovicu.
Príklady uplatňovania princípu AUFBAU
Ďalej existuje 5 príkladov prvkov, ktoré spĺňajú princíp AUFBAU:
Príklad 1: Elektronická konfigurácia sodný
Sodík je prvkom 11, takže má 11 protónov a 11 elektrónov. Jeho elektronická konfigurácia je 1s2 2s2 2 P6 3s1.
Príklad 2: Argonová elektronická konfigurácia
Argon (AR) je prvkom 18, takže má 18 protónov a 18 elektrónov. Jeho elektronická konfigurácia je preto 1S2 2s2 2 P6 3s23p6. Je zrejmé, že jeho čiastkové úrovne a sub -stupne P boli úplne.
Môže vám slúžiť: Propylén (C3H6)Príklad 3: Konfigurácia elektronického galia
Gallium (GA) je prvkom 31, takže má 31 protónov a 31 elektrónov. Jeho elektronická konfigurácia je 1s2 2s2 2 P6 3s23p64s23D104p1.
Toto je možné napísať súhrnným spôsobom ako [ar] 4s23D104p1, kde [AR] predstavuje elektronickú konfiguráciu argónu uvedenú v predchádzajúcom príklade.
Príklad 4: Elektronická konfigurácia uhlíka
Uhlík (c) je prvkom 6, takže má 6 protónov a 6 elektrónov. Jeho elektronická konfigurácia je 1s2 2s2 2 P2.
Príklad 5: Konfigurácia elektronického chlóru
Chlór (cl) je prvok 17. Jeho 17 elektrónov je distribuovaných podľa nasledujúcej elektronickej konfigurácie: 1s2 2s2 2 P6 3s23p5 alebo [ne] 3s23p5.
Ďalšie príklady výnimiek na začiatku aufbau
Ďalej existujú 2 ďalšie príklady prvkov, ktoré porušujú princíp AUFBAU:
Príklad 6: Elektronická konfigurácia molybdénu
Molybdén (MO) je prvok 42. Prvých 36 elektrónov je distribuovaných rovnakým spôsobom ako v kryptone, ale jeho valenčné elektróny nedodržiavajú normálne poradie. Namiesto elektronickej konfigurácie [KR] 5S24d4, Jeho konfigurácia je [KR] 5s14d5, Podobne ako s chrómom.
Príklad 7: Strieborná elektronická konfigurácia
La Plata (Ag, Element 47) predstavuje porušenie princípu Aufbau podobného princípu medi. Jeho elektronická konfigurácia je [KR] 5S14d10 Namiesto [KR] 5S24d9.

