Oktet

- 2038
- 147
- Valentín Dula
 Reprezentácia molekuly oxidu uhličitého ukazujúca súlad s oktetovým pravidlom
Reprezentácia molekuly oxidu uhličitého ukazujúca súlad s oktetovým pravidlom Aké je pravidlo oktetu?
Ten Oktet Je to praktické pravidlo, ktoré vysvetľuje tvorbu chemickej väzby reprezentatívnych prvkov založených na elektronickej konfigurácii jej valenčnej vrstvy.
Podľa tohto pravidla sa atómy navzájom kombinujú takým spôsobom, že každý atóm je obklopený ôsmimi elektrónmi vo svojej valenčnej vrstve (odtiaľ slovný oktet).
Toto pravidlo bolo uverejnené súčasne v 1.916 Gilbert Lewis a Walther Kossel. Odráža pozorovanie, že ušľachtilé plyny sú veľmi stabilné a všetky, s výnimkou hélia, sa vyznačujú tým, že majú valenčnú vrstvu s 8 elektrónmi.
Teória stanovuje, že atómy zdieľajú alebo vymieňajú elektróny vytvorením chemických väzieb, aby sa získala táto úplná elektronická konfigurácia.
Oktetové pravidlo a Lewisove štruktúry
Oktetové pravidlo a Lewisove štruktúry úzko súvisia. Je to preto, že oktetové pravidlo je jednou zo základov na pochopenie tvorby chemickej väzby, takže vo väčšine prípadov umožňuje predpovedať Lewisovu štruktúru chemikálií.
V tomto zmysle je jedným zo základných krokov na nakreslenie štruktúry Lewis po umiestnení jednoduchých väzieb medzi všetkými atómami, ktoré tvoria molekulu, rozdeliť zostávajúce valenčné elektróny medzi najviac elektronegatívnym atómom na dokončenie svojich oktetov.
V prípadoch, keď sú oktety bez plnenia, vytvárajú sa dvojité alebo trojité väzby, vždy hľadajú pravidlo oktetu pre čo najviac atómov. Takže toto empirické pravidlo je nevyhnutné pre výstavbu Lewisových štruktúr.
Môže vám slúžiť: Silver Yoduro (AGI): Štruktúra, vlastnosti, získanie, použitiaPríklady dodržiavania pravidla oktetu
Pravidlo oktetu sa uplatňuje hlavne na reprezentatívne prvky, tj na bloky S a P blokov periodickej tabuľky. Toto pravidlo sa neustále aplikuje na zlúčeniny, ktoré obsahujú uhlík, dusík, kyslík a halogény, a až na niektoré výnimky od ostatných prvkov bloku P blok. Väčšina prechodných kovov však nespĺňa.
Niektoré príklady zlúčenín, v ktorých je pravidlo oktetu splnené pre všetky atómy, sú:
Oxid uhličitý (CO2)
Ako je možné vidieť v Lewisovej štruktúre oxidu uhličitého uvedeného nižšie, centrálny uhlík aj atómy kyslíka sú v súlade s oktetovým pravidlom.
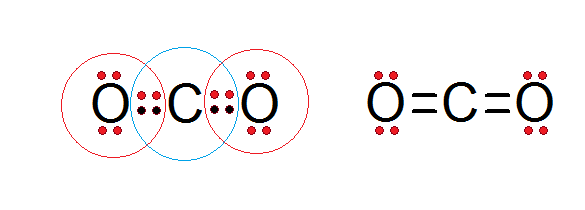
Uhlík je obklopený svojimi 4 valenčnými elektrónmi, plus dva elektróny z každého kyslíka, ktoré prispievajú k vytvoreniu dvojitých väzieb C = o, zatiaľ čo každý kyslík je obklopený 6 vlastnými elektrónmi plus pár z uhlíka.
Neopentano (c5H12)
V drvivej väčšine organických zlúčenín všetky atómy spĺňajú pravidlo oktetu (s výnimkou vodíka, ktorý je obklopený iba 2 elektrónmi). To zahŕňa alkány, ako je Neopentano alebo 2,2-dimetylpropán:
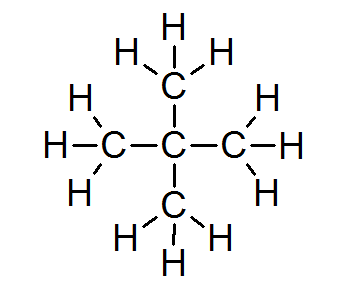
V tomto prípade je tiež zrejmé, že každý atóm uhlíka zdieľa svoje štyri elektróny so 4 susednými atómami, z ktorých každý poskytuje jeden zo svojich elektrónov, aby vytvoril 4 jednoduché kovalentné väzby, ktoré udržiavajú pohromade pohromade.
Z tohto dôvodu je každý atóm uhlíka obklopený 8 valenčnými elektrónmi, čo je v súlade s oktetovým pravidlom.
Môže vám slúžiť: aktivačná energiaOxid uhoľnatý (CO)
Oxid uhoľnatý je ďalšia molekulárna zlúčenina, v ktorej kyslík a uhlík zdieľajú elektróny tvoriace kovalentnú väzbu na uspokojenie oktetového pravidla.
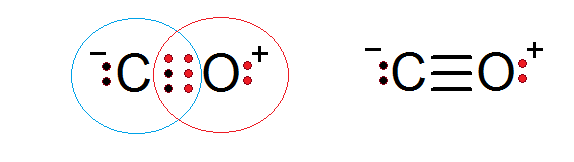
V tomto prípade uhlík poskytuje dva elektróny a kyslík 4 na dokončenie 6 elektrónov potrebných na vytvorenie trojitej kovalentnej väzby, ktorá ich spája. Každý z týchto dvoch atómov má ďalšie elektróny bez zdieľania, ktoré dokončujú každý oktet.
Anión dusičnanov (nie3-)
Aj v prípade iónov je pravidlo oktetu splnené. Dusičnanový ión má centrálny atóm dusíka obklopený 3 atómami kyslíka.
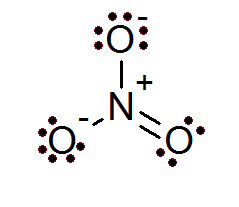
Ako je možné vidieť v tomto prípade, všetky atómy majú svoj celý oktet, dva z kyslíka majú negatívnu formálnu záťaž, zatiaľ čo dusík má pozitívne formálne zaťaženie, čo vedie k čistému zaťaženiu -1 dusičnanového iónu.
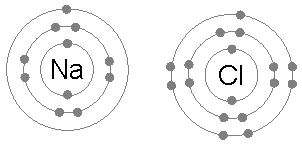
Chlorid sodný (NaCl)
Výmena elektrónov za vzniku iónových zlúčenín je tiež bežným príkladom uplatňovania pravidla oktetu.
Keď sa chlorid sodný tvorí z chlóru a sodíka, začína sa z dvoch atómov, ktoré nespĺňajú pravidlo oktetu, pretože sodík na elektróne a chlóru nemá jeden na dokončenie svojho oktetu.
Potom sodík dáva svoj elektrón chlóru, pričom katión obklopuje 8 elektrónmi a následne dokončuje oktet na chlór vytvorením chloridového iónu.
 Výnimky z oktetového pravidla
Výnimky z oktetového pravidla
Rovnako ako existuje veľké množstvo zlúčenín, v ktorých všetky atómy spĺňajú oktetové pravidlo, existuje aj viac príkladov atómov, ktoré s tým nespĺňajú.
Môže vám slúžiť: potenciál z: hodnoty, stupne koagulácie, určenie, použitieNiektoré sú obklopené menej ako 8 elektrónmi, takže sú úbohý druh elektrónov, Zatiaľ čo iní sú obklopení viac ako ôsmimi elektrónmi, v takom prípade sa hovorí, že má rozšírený oktet alebo sa nazýva Hypervalentný atóm.
Príklady zlých druhov elektrónov
Bordean (BH3)
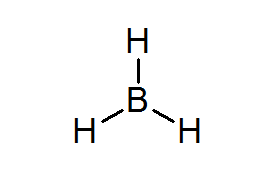
Táto zlúčenina je typickým príkladom slabého druhu elektrónov. Ani bór, ani okolité vodíny, nemajú dostatok elektrónov na uspokojenie pravidla oktetu v centrálnom atóme. To spôsobí, že Bór dostane pár elektrónov z iného atómu v inej molekule, čím sa z lewisa premení na kyselinu na kyselinu na kyselinu.
Hliník triklurur (Alcl3)
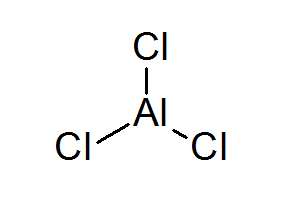
Alcl3 Je to ďalší príklad Lewisovej kyseliny, ktorá dlhuje jej chemické správanie, ktorému nespĺňa pravidlo oktetu.
Príklady hypervaluentných druhov
Síra hexafluoruro (sf6)
Typickým príkladom rozšíreného oktetu je SF6, ktorá je zvyčajne znázornená ako centrálna síra so 6 jednoduchými kovalentnými väzbami s atómami fluóru. V tomto prípade je síra obklopená 12 valenčnými elektrónmi namiesto 8, takže porušuje pravidlo oktetu.
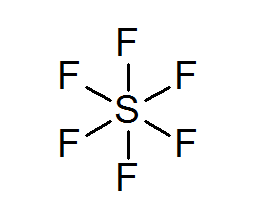
Napriek tomu boli navrhnuté modely, v ktorých je síra v skutočnosti spojená s kovalentnými väzbami so 4 fluormi súčasne, zatiaľ čo s ostatnými dvoma, formujte iónové väzby. Ak áno, splnilo by to pravidlo oktetu.
Fosfor pentachlorid (PCL5)
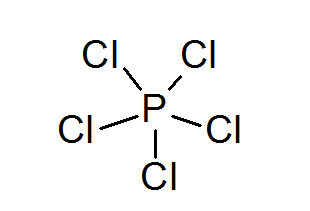
Rovnako ako v prípade síry, fosfor môže tiež tvoriť zlúčeniny s rozšírenými oktetmi, v tomto prípade obklopený 10 elektrónmi.

