Elektronická príbuznosť

- 2897
- 334
- Gabriel Bahna
Čo je elektronická afinita?
Ten Elektronická príbuznosť Je definovaná ako množstvo energie uvoľňovanej, keď je mol atómov v plynnom stave kombinovaný s mol elektrónom, aby sa vytvoril krtek aniónov, tiež v plynnom stave. Inými slovami, vzťahuje sa na negatívnu variáciu entalpie nasledujúceho procesu:
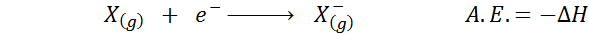
Ako už názov napovedá, elektronická afinita (a.A.) Je to miera trendu, ktorý má atóm pripojiť sa k elektrónu. To znamená, že meria afinitu atómu pre elektróny.
Interpretácia elektronickej afinity
Vzhľadom na spôsob, akým je definovaný, vysoká elektronická afinita znamená, že variácia entalpie je veľmi negatívna. To zase naznačuje, že tento proces je energicky priaznivý a že výrobky sú stabilnejšie ako reagencie. Z tohto dôvodu by sme mohli tiež povedať, že elektronická afinita je nepriamou mierou stability aniónu.
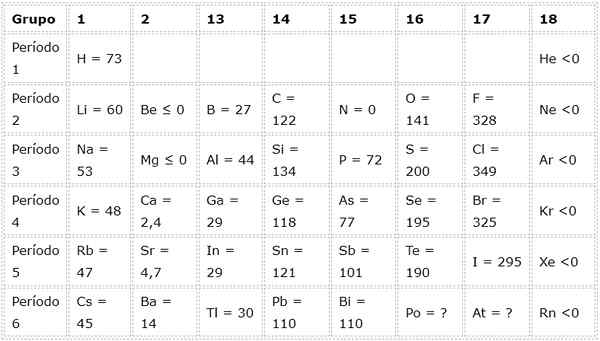
Čím väčšia je elektronická afinita atómu, tým väčší je trend tvoriť anión. To je dôvod, prečo atómy ako chlór, ktorého elektronická afinita je 349 kJ/mol, majú tendenciu ľahko tvoriť anióny (v tomto prípade chlorid anión), zatiaľ čo iné atómy, ako je horčík, ktorého elektronická afinita je negatívna, netvarujú anióny.
Objasnenie elektronickej afinity a ionizačnej energie
Mnohokrát uvažujete o elektronickej afinite ako na opak ionizačnej energie (tendencia plynného atómu stratiť elektrón), ale to nie je také. Zvážte napríklad atóm x.
Môže vám slúžiť: Tusfrano: chemická štruktúra, vlastnosti a použitiaJeho elektronická afinita sa vzťahuje na zmenu energie procesu uvedeného vyššie v prvej rovnici. Jeho ionizačná energia sa však týka zmeny energie, keď atóm stratí elektrón:
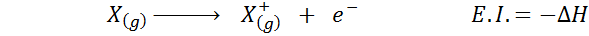
Aj keď sa táto reakcia javí ako opačná reakcia na predchádzajúce.
Čo určuje elektronickú afinitu?
Aby sme vedeli, aké charakteristiky atómu ovplyvňujú hodnotu jeho elektronickej afinity, je potrebné zvážiť stabilitu pôvodného atómu, ako aj tvorbu aniónu. Ak je anión stabilnejší ako atóm, potom bude elektronická afinita vysoká, inak bude nízka alebo dokonca negatívna.
Ale ako zistiť, ktorý z týchto dvoch druhov je stabilnejší? Z tohto dôvodu sa spoliehame na dva faktory:
- Elektronická konfigurácia. Existujú stabilnejšie elektronické nastavenia ako iné. Všeobecne platí, že konfigurácia celej vrstvy (napríklad ušľachtilé plyny) je najstabilnejšia zo všetkých. Potom nasleduje konfigurácia vrstvy semilele, v ktorej majú všetky orbitály vrstvy Valencie polovicu elektrónov, ktoré mohli mať (napríklad 4s14p3).
- Elektronické odpudenie. Ak sa porovnáva aj anión zaťaženia -1, s aniónom zaťaženia -2, v druhom prípade dôjde k oveľa väčšiemu odporu medzi elektrónmi, ktoré destabilizuje anión.
Pravidelná elektronická afinitná tendencia
 Graf ukazujúci elektronické afinity prvých 9 prvkov periodickej tabuľky
Graf ukazujúci elektronické afinity prvých 9 prvkov periodickej tabuľky Elektronická afinita je jednou z pravidelných vlastností prvkov. To znamená, že je to vlastnosť, ktorá sa predvídateľne líši od jedného prvku k druhému v závislosti od jeho polohy v periodickej tabuľke. Všeobecne povedané, elektronická afinita sa zvyšuje so zmenšovaním veľkosti atómu.
Môže vám slúžiť: polo rozvinutý vzorec: Čo je a príklady (metán, propán, bután ...)V tomto zmysle sa veľkosť atómov líši v závislosti od obdobia a skupiny, v ktorej sa nachádza, takže jej elektronická afinita sa tiež líši, ako je vysvetlené nižšie:
Variácia elektronickej afinity za určité obdobie
Aspoň pre reprezentatívne prvky (tie, ktoré patria do blokov S a P periodickej tabuľky), je možné poznamenať, že elektronická afinita má všeobecnú tendenciu zvyšovať sa zľava doprava v dôsledku zvýšenia účinného jadrového zaťaženia, ktoré má je schopný prilákať elektróny s väčšou silou.
Napríklad, ak vezmeme 3. perióda periodickej tabuľky, vidíme, že elektronická afinita Li (60 kJ/mol) je menšia ako v prípade kyslíka (141 kJ/mol), a to je menšia ako fluorid (328 kJ /mol).
Výnimka
Predchádzajúce pravidlo nie je vždy splnené.
Po prvé, pri prechode z alkalických kovov do alkalinerov sa elektronická afinita znižuje. Je to preto, že pre alkalické kovy (NS Electronic Configuration1) Je priaznivé zachytiť elektrón, pretože by dokončili naplnenie orbitálu S.
V prípade alkalineros (elektronická konfigurácia ns2) Zachytenie elektrónu je nepriaznivé, pretože už majú svoj plný orbitál. To isté sa stáva pri prechode od halogénov (ktoré majú elektronické afinity všetkých prvkov) na vznešené plyny.
Variácia elektronickej afinity v celej skupine
V prípade skupín je správanie ešte menej predvídateľné. Všeobecným pravidlom je, že a.A. Zvyšuje sa zdola nahor v rovnakom smere, ktorý znižuje atómový polomer. Pre alkalické a halogénové kovy je toto pravidlo splnené celkom dobre. To sa však nestane s väčšinou ostatných skupín.
Môže vám slúžiť: kobaltový hydroxidPríklady elektronickej afinity niektorých reprezentatívnych prvkov
Nasledujúca tabuľka ukazuje elektronické hodnoty afinity v (kJ/mol) Reprezentatívne prvky Zoradené podľa skupiny:
Nižšie sú uvedené niekoľko príkladov elektronickej afinity spolu s reakciou, na ktorú odkazujú:
1. Elektronická afinita
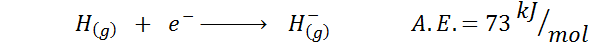
2. Elektronická afinita
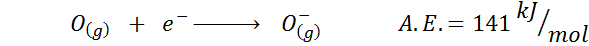
3. Aniónová elektronická afinita
Ďalším spoločným príkladom je prípad elektronickej afinity aniónu, ako je alebo-. A.A. V tomto prípade je daná energiou spojenou s nasledujúcim procesom:
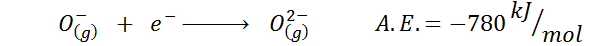
Ako je vidieť, táto elektronická afinita je silne negatívna, aj keď ión alebo2- Má elektronickú neónovú konfiguráciu (ušľachtilý plyn) a je veľmi bežným iónom v mnohých iónových tuhých látkach.
Dôvodom je to, že odpudenie negatívnych obvinení v OR2- destabilizuje tento plynný ión stavu, ale v tuhom stave je zaťaženie stabilizované katiónmi, ktoré ho obklopujú.

