Hydracia
- 1312
- 54
- MUDr. Žigmund Boška
Čo sú hydrace?
Ten Hydracia, o Binárne kyseliny, sú zlúčeniny rozpustené vo vode, ktoré sú zložené z vodíka a nemetalického prvku: halogenidy vodíka. Jeho všeobecný chemický vzorec sa dá vyjadriť ako HX, kde H je atóm vodíka a x nemetalický prvok.
X môže patriť do skupiny 17, halogény alebo do prvkov skupiny 16 bez zahrnutia kyslíka. Na rozdiel od oxoacidov, hydracidy nemajú kyslík. Pretože hydraceidy sú kovalentné alebo molekulárne zlúčeniny, musí sa zvážiť spojenie H-X. To má veľký význam a definuje charakteristiky každej hydracie.
Odkaz H-X
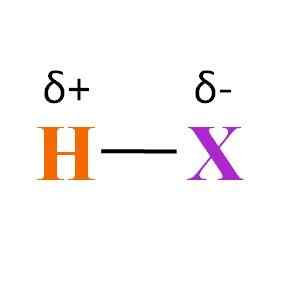 Všeobecný chemický vzorec hydraty. Zdroj: Gabriel Bolívar
Všeobecný chemický vzorec hydraty. Zdroj: Gabriel Bolívar Čo sa dá povedať o odkaze H-X? Ako je možné vidieť na vynikajúcom obraze, existuje trvalý moment dipólového momentu produktu rôznych elektronegativitov medzi H a X. Pretože X je zvyčajne viac elektronegatívny ako H, priťahuje jeho elektronický oblak a končí negatívnym čiastočným zaťažením δ-.
Namiesto toho H, keď dáva časť svojej elektronickej hustoty X, končí pozitívnym čiastočným zaťažením δ+. Čím negatívnejší δ-, najbohatší v elektronoch bude x a čím väčší je elektronický nedostatok H. Preto v závislosti od toho, aký prvok je x, môže byť hydrakencia viac -menej polárna.
Obrázok tiež ukazuje štruktúru hydracidí. H-X je lineárna molekula, ktorá môže interagovať s iným jedným z jej koncov. Čím viac je to Hx, jeho molekuly budú interagovať s väčšou silou alebo afinitou. Výsledkom je, že jeho body varu alebo fúzie sa zvýšia.
Interakcie H-X-H-X však zostávajú dostatočne slabé na to, aby spôsobili pevnú hydráku. Preto sú za podmienok tlaku a okolitej teploty plynné látky; s výnimkou HF, ktorý sa odparuje nad 20 ° C.
Pretože? Pretože HF je schopný tvoriť silné vodíkové mosty. Zatiaľ čo iné hydraceidy, ktorých nemetalické prvky sú menej elektronegatívne, môžu byť sotva v kvapalnej fáze pod 0 ° C. Napríklad HCl približne uvarte pri -85 ° C približne.
Sú látky hydracezných kyselín? Odpoveď je v pozitívnom čiastočnom záťaži A+ na atóme vodíka. Ak je A+ veľmi veľký alebo veľmi slabá väzba H-X, potom HX bude silnou kyselinou, ako je to v prípade všetkých halogénových hydracénov, akonáhle sa ich príslušné halogenidy rozpustia vo vode.
Charakteristika hydrace
Fyzický
Priehľadné riešenia
Viditeľne všetky hydracidy sú priehľadné roztoky, pretože HX sú veľmi rozpustné vo vode. Môžu mať žltkasté tóny podľa rozpustených koncentrácií HX.
Fajčia
To znamená, že vydávajú hustoty, korozívne a dráždivé pár (niektoré z nich sú dokonca naubeabundos). Je to preto, že molekuly HX sú veľmi prchavé a interagujú s vodnou parou obklopujúcou roztoky. Okrem toho sú HX v ich bezvodých formách plynné zlúčeniny.
Sú to elektrické vodiče
Hydracia sú dobré vodiče elektriny. Aj keď HX sú plynné druhy v atmosférických podmienkach, keď sa rozpúšťajú vo vode, uvoľňujú ióny (H+X-), ktoré umožňujú priechod elektrického prúdu.
Môže vám slúžiť: termodynamické procesyJeho body varu sú vyššie ako body ich bezvodých foriem
To znamená, Hx (AC), ktorý označuje hydraciu, vrie pri teplotách vyšších ako HX (G). Napríklad chlorid vodíka, HCl (G), vrie pri -85 ° C, ale kyselina hydrachlórová, jej hydracia, okolo 48 ° C.
Pretože? Pretože Hx Gaseous Molekuly sú obklopené vodou. Medzi nimi sa môžu vyskytnúť dva typy interakcií súčasne: hx - h mosty2Alebo - Hx alebo Ion Roldertion, H3Ani+(Ac) a x-(Ac). Táto skutočnosť priamo súvisí s chemickými charakteristikami hydráky.
Chemikálie
Hydrakidy sú veľmi kyslé roztoky, takže majú kyslé protóny h3Ani+ K dispozícii na reagovanie s inými látkami.
Kam vznikne h3Ani+? Atómu vodíka s pozitívnou čiastočnou záťažou A+, ktorý sa disociuje vo vode a končí kovalentne začlenením do molekuly vody:
HX (ac) + h2O (l) x-(Ac) + h3Ani+(Ac)
Všimnite si, že rovnica zodpovedá reakcii, ktorá stanovuje rovnováhu. Keď tvorba x-(Ac) + h3Ani+(AC) je termodynamicky veľmi obľúbený, HX uvoľní svoj vodný protón do vody; A potom toto, s H3Ani+ Ako jeho nový „nositeľ“ môžete reagovať s inou zlúčeninou, aj keď táto nie je silnou základňou.
Vyššie uvedené vysvetľuje kyslé charakteristiky hydrace. Stáva sa to pre všetky HX rozpustené vo vode; ale niektoré generujú viac kyslých roztokov ako iné. Za čo je toto? Dôvody môžu byť veľmi komplikované. Nie všetci HX (AC) uprednostňujú predchádzajúcu rovnováhu napravo, to znamená smerom k x-(Ac) + h3Ani+(Ac).
Kyslosť
A výnimka je pozorovaná vo fluórickej kyseline, HF (AC). Fluór je preto veľmi elektronegatívny, a preto skráti vzdialenosť spojenia H-X, čím sa posilňuje pred jeho prasknutím vodou pôsobením.
Podobne má odkaz H-F oveľa lepšie prekrývanie z dôvodov atómových rádií. Na druhej strane, odkazy H-Cl, H-Br alebo H-I sú slabšie a majú tendenciu úplne disociovať vo vode, až do bodu prelomenia s rovnováhou zvýšenou nad.
Je to preto, že ostatné halogény alebo kalkogény (napríklad síra) majú väčšie atómové rádiá, a teda viac objemných orbitálov. V dôsledku toho odkaz H-X predstavuje najchudobnejšie orbitálne prekrývanie, pretože X je väčší, čo má zase kyslú silu, keď sú v kontakte s vodou.
Týmto spôsobom je klesajúce poradie kyslosti halogénových hydracidov nasledujúce: HF< HCl Vo svojich bezvodých formách, HX (G), by sa mali uviesť ako diktované pre halogenidy vodíka: pridanie prípony -aurochy Na konci ich mien. Napríklad HI (G) pozostáva z halogenidu (alebo hydridu) tvoreného vodíkom a jódom, preto je jeho názov: yodaurochy vodík. Pretože zvyčajne sú ne -metály viac elektronegatívne ako vodík, má oxidačné číslo +1. Na druhej strane v NAH má vodík oxidačné číslo -1. Toto je ďalší nepriamy spôsob diferenciácie molekulárnych hydrorov od halogénov alebo halogenidov vodíka z iných zlúčenín. Akonáhle je HX (g) medzi kontaktom s vodou, je znázornený ako HX (AC) a potom má hydraciu. Na vymenovanie Hydracy, HX (AC), bude potrebné vymeniť príponu -aurochy jeho bezvodých foriem prípony -Vodná voda. A malo by sa najskôr uviesť ako kyseliny. Pre predchádzajúci príklad je teda HI (AC) pomenovaný ako: kyselina yodVodná voda. Hydraceidy sa môžu tvoriť jednoduchým rozpustením ich zodpovedajúcich halogenidov vodíka vo vode. To môže byť predstavované s nasledujúcou chemickou rovnicou: Hx (g) => hx (ac) HX (G) je veľmi rozpustný vo vode, takže na rozdiel od jej iónovej disociácie nie je rovnováha rozpustnosti, aby sa uvoľnili kyslé protóny. Existuje však syntetická metóda, ktorá sa uprednostňuje, pretože používa ako soli surovín alebo minerály, čím sa rozpustí pri nízkych teplotách so silnými kyselinami. Ak sa stolová soľ, NaCl, rozpustí s koncentrovanou kyselinou sírovou, nastane nasledujúca reakcia: NaCl (s) +h2SW4(ac) => hcl (ac) +Nahso4(Ac) Kyselina sírová daruje jeden zo svojich kyslých protónov na aniónový chlorid Cl-, Tým sa premení na kyselinu chlorovodíkovú. Z tejto zmesi môže uniknúť chloridu vodíka, HCl (G), pretože je veľmi prchavá, najmä ak je jej koncentrácia vo vode veľmi vysoká. Druhou produkovanou soľou je síran kyseliny sodná, Nahso4. Ďalším spôsobom jeho výroby je nahradiť kyselinu sírovú koncentrovanou kyselinou fosforečnou: NaCl (s) + h3Po4(ac) => hcl (ac) + nie2Po4(Ac) H3Po4 reaguje rovnakým spôsobom ako h2SW4, Výroba kyseliny chlorovodíkovej a fosforečnanu sodný. NaCl je zdrojom cl aniónu-, takže na syntézu ostatných hydracest, solí alebo minerálov obsahujúcich F sú potrebné-, Br-, Jo-, Siež2-, atď. Ale použitie H2SW4 alebo h3Po4 Bude závisieť od jej oxidačnej sily. H2SW4 Je to veľmi silné oxidačné činidlo do bodu, ktorý oxiduje aj BR- a ja- do svojich molekulárnych foriem Br2 a ja2; Prvým je červenkastá tekutina a druhá fialová pevná látka. Preto h3Po4 predstavuje preferovanú alternatívu v takejto syntéze. Hydrakidy sa v podstate používajú na rozpustenie rôznych typov hmoty. Je to preto, že sú to silné kyseliny a s mierou môžu vyčistiť akýkoľvek povrch. Ich kyslé protóny sa pridávajú do zlúčenín nečistôt alebo nečistôt, vďaka čomu sú rozpustné vo vodnom prostredí a potom sú ťahané vodou. Podľa chemickej povahy uvedeného povrchu sa môže použiť hydracia alebo iné. Napríklad kyselina fluórická sa nemožno použiť na čistenie skla, pretože by ich rozpustilo v konaní. Kyselina chlorovodíková sa používa na odstránenie škvŕn na dlaždiciach bazénu. Sú tiež schopné rozpustiť horniny alebo tuhé vzorky a potom sa používajú na analytické alebo výrobné účely do malých alebo veľkých mierok. Pri výmene iónov sa na čistenie zostávajúcej iónovej kolóny používa zriedená kyselina chlorovodíková zriedená kyselina chlorovodíková. Niektoré reakcie si vyžadujú veľmi kyslé roztoky na ich urýchlenie a skrátenie času, ktorý sa odohráva. Tam vstupujú hydracidy. Príkladom je použitie kyseliny iahydrovej v syntéze kyseliny octovej. Ropný priemysel tiež potrebuje hydracery v rafinérskych procesoch. Hydrakidy poskytujú nielen kyslé protóny, ale aj ich príslušné anióny. Tieto anióny môžu reagovať s organickou alebo anorganickou zlúčeninou za vzniku špecifického halogenidu. Týmto spôsobom, fluoridy, chloridy, jodid. Tieto halurózy môžu mať veľmi rozmanité aplikácie. Môžu sa napríklad použiť na syntézu polymérov, ako je teflón; alebo sprostredkovatelia, z ktorých sa atómy halogénu začleňujú do molekulárnych štruktúr určitých liekov. Predpokladajme, že molekula ch3Chvály2Oh, etanol, reaguje s HCl za vzniku etylchloridu: Chvály3Chvály2OH + HCL => CH3Chvály2CL + H2Ani Každá z týchto reakcií skrýva mechanizmus a mnoho aspektov, ktoré sa berú do úvahy v organickej syntéze. Pre hydracidy nie je k dispozícii veľa príkladov, pretože počet možných zlúčenín je prirodzene obmedzený. Z tohto dôvodu sú niektoré ďalšie hydracidy uvedené nižšie s ich príslušnou nomenklatúrou (skratka (AC)) sa ignoruje: Binárny hydraceid, ktorého molekuly H-F tvoria silné vodíkové mosty do tej miery, že vo vode je to slabá kyselina. Na rozdiel od hydracidov, ktoré sa dovtedy uvažujú, je polyiatomický, to znamená, že má viac ako dva atómy, ale naďalej je binárny, pretože ide o dva prvky: síra a vodík. Jeho uhlové molekuly H-S-H netvoria značné vodíkové mosty a môžu byť detegované ich charakteristickou hnilobou zhnitých vajíčok. Jedna z najznámejších kyselín v populárnej kultúre. Je dokonca súčasťou zloženia žalúdočnej šťavy, ktorá sa vyskytuje v žalúdku a spolu s tráviacimi enzýmami, ktoré degradujú jedlo. Ako kyselina iahydrová, v plynnej fáze pozostáva z H-BR lineárnych molekúl, ktoré sa disociujú s iónmi H+ (H3Ani+) a br- Keď vstúpia do vody. Aj keď telurio má určitý kovový charakter, jeho hydrosencia vydáva nepríjemné a extrémne jedovaté výpary, ako je kyselina seleenhydrová. Ako aj ďalšia hydracia stôp2-, Takže jeho Valencia je -2.Nomenklatúra hydrakidov
Bezvodie
Vo vodnom roztoku
Ako je to hydrace?
Priame rozpustenie halogenidov vodíka
Rozpustenie solí nemetálnom slaom s kyselinami
Použitie hydrace
Čistiace prostriedky a rozpúšťadlá
Kyslé katalyzátory
Reagencie syntézy organických a anorganických zlúčenín
Príklady hydracestov
HF, kyselina fluórska
H2Kyselina sulfhydrová
HCl, kyselina chlorovodíková
HBR, kyselina bromhydrová
H2Čaj, kyselina telurhydrová
Odkazy

