Londýnske sily
- 2007
- 452
- Václav Višňovský
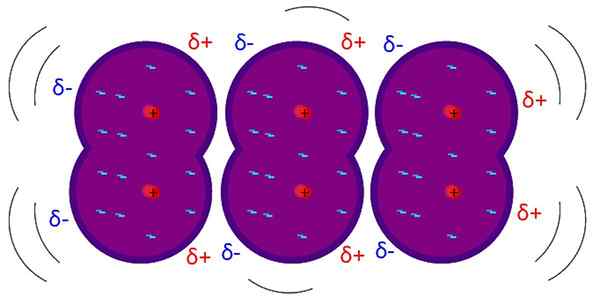
 Londýnske sily sú intermolekulárne slabé interakcie. Zdroj: Riccardo Rovinetti, Wikimedia Commons
Londýnske sily sú intermolekulárne slabé interakcie. Zdroj: Riccardo Rovinetti, Wikimedia Commons Aké sú londýnske sily?
Ten Londýnske sily, Londýnske disperzné sily alebo indukované dipólové interakcie sú najslabším typom intermolekulárnych interakcií. Jeho meno je spôsobené prínosmi teoretického fyzika Fritza London (1900-1954) a jeho štúdia v oblasti kvantovej fyziky.
Londýnske sily vysvetľujú, ako molekuly interagujú, ktorých štruktúry a atómy vytvárajú tvorbu trvalého dipólu; To znamená, že sa v zásade vzťahuje na apolárne molekuly alebo atómy izolované z ušľachtilých plynov.
Na rozdiel od ostatných síl Van der Waals to vyžaduje extrémne krátke vzdialenosti.
Charakteristiky londýnskych síl
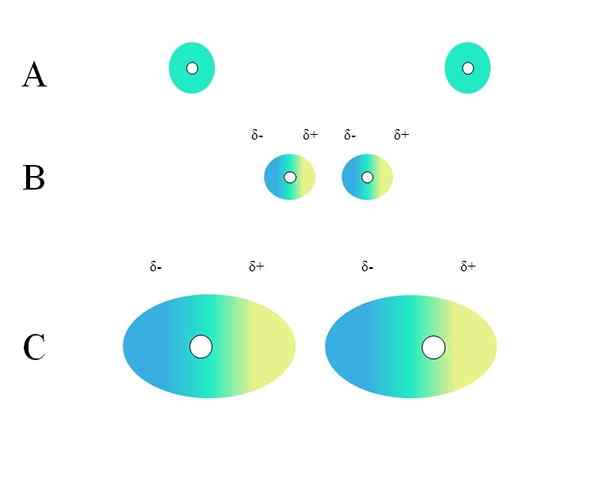 Distribúcia homogénnych poplatkov. Zdroj: Gabriel Bolívar
Distribúcia homogénnych poplatkov. Zdroj: Gabriel Bolívar Aké vlastnosti by mali mať molekula, aby mohla interagovať cez londýnske sily? Odpoveď je, že to by to mohol urobiť, ale keď existuje trvalý dipólový moment, interakcie typu dipól-dipolo prevažujú skôr ako disperzia, čo veľmi málo prispieva k fyzickej povahe látok.
V štruktúrach, kde nie sú veľmi elektronegatívne atómy alebo ktorých distribúcia elektrostatického zaťaženia je homogénna, neexistuje žiadny koniec ani oblasť, ktorá by sa dala považovať za bohaté (A-) alebo zlé (A+) v elektronoch.
V týchto prípadoch musia zasahovať iné typy síl alebo inak by tieto zlúčeniny mohli existovať iba v plynnej fáze, bez ohľadu na tlakové alebo teplotné podmienky, ktoré na nich pôsobia.
Homogénna distribúcia záťaže
Dva izolované atómy, ako napríklad neón alebo argón, majú homogénne rozdelenie záťaže. Toto je vidieť na A, vynikajúci obraz. Biele kruhy v strede predstavujú jadrá pre atómy alebo molekulárnu kostru pre molekuly. Toto rozdelenie záťaže možno považovať za oblak zelených elektrónov.
Prečo sa vznešené plyny stretávajú s touto homogenitou? Pretože majú svoju elektronickú vrstvu úplne plnú, takže ich elektróny sa teoreticky musia cítiť rovnako zaťažovacou príťažlivosťou jadra na všetkých orbitáloch.
Na druhej strane, pre iné plyny, ako je atómový kyslík (O), je jeho vrstva neúplná (ktorá je pozorovaná v jej elektronickej konfigurácii) a núti ju tvoriť diatomickú molekulu alebo2 Kompenzovať tento nedostatok.
Zelené kruhy A môžu byť tiež molekuly, malé alebo veľké. Jeho obrúsky elektróny okolo všetkých atómov, ktoré ho tvoria, najmä o najviac elektronegatívnych. Okolo týchto atómov sa oblak bude sústrediť a bude viac negatívny, zatiaľ čo iné atómy budú mať elektronický nedostatok.
Môže vám slúžiť: ne -polárne kovalentné putoTento oblak však nie je statický, ale dynamický, takže v určitom okamihu sa vytvoria krátke oblasti δ a δ+a vyskytne sa fenomén nazývaný nazývaný jav Polarizácia.
Polarizovateľnosť
V zelenom oblaku naznačuje homogénne distribúciu záporného zaťaženia. Pozitívna príťažlivosť však, ktorú vyvíja jadro, sa môže pohybovať na elektronoch. To spôsobuje deformáciu mraku, čím sa vytvorí δ- oblasti, modré a δ+, žlté.
Tento náhly dipólový moment v atóme alebo molekule môže skresliť susedný elektronický oblak; Inými slovami, indukuje náhle dipól nad jeho susedom (B, vynikajúci obraz).
Je to preto, že oblasť ô narušuje susedný oblak, jeho elektróny cítia elektrostatické odpudenie a sú orientované v opačnom póle, ktoré sa objavujú δ+.
Všimnite si, ako sú pozitívne póly v súlade s negatívami, rovnako ako molekuly s trvalými dipólovými momentmi. Čím objemnejší je elektronický oblak, tým väčšia je ťažkosti, Jadre bude udržiavať homogénne vo vesmíre; A navyše to bude jeho deformácia, ako bude vidieť v C.
Preto nie je pravdepodobnejšie, že malé atómy a molekuly nebudú polarizované akýmkoľvek časticou svojho okolia. Príklad tejto situácie ilustruje malá molekula vodíka, h2.
Na kondenzáciu alebo ešte viac kryštalizácie potrebujete prehnané tlaky, aby prinútili svoje molekuly fyzicky interagovať.
Je nepriamo úmerný vzdialenosti
Aj keď sa vytvárajú okamžité dipóly, ktoré vyvolávajú ostatných okolo nich, nestačia na to, aby udržali atómy alebo molekuly pohromade.
V B je vzdialenosť d To oddeľuje dva oblaky a ich dve jadrá. Aby oba dipóly mohli zostať na čas zváženia, táto vzdialenosť d Musí to byť veľmi malé.
Táto podmienka sa musí splniť, čo je nevyhnutná charakteristika londýnskych síl (nezabudnite na zatvorenie suchého zipsu), takže sa dodáva notorický vplyv na fyzikálne vlastnosti veci.
Raz d Byť malý, jadro ľavého v B začne priťahovať modrú oblasť δ- susedného atómu alebo molekuly. To bude ďalej deformovať oblak, ako je vidieť v C (jadro už nie je v strede, ale vpravo).
Môže vám slúžiť: AlkényPotom je tu bod, v ktorom sa oba oblaky dotýkajú a „odskočia“, ale na dosť pomaly, aby ich mali spolu s časom.
Preto sú londýnske sily nepriamo úmerné vzdialenosti d. V skutočnosti sa tento faktor rovná d7, Takže minimálna variácia vzdialenosti medzi atómami alebo molekulami oslabí alebo posilní disperziu Londýna.
Je priamo úmerný molekulárnej hmotnosti
Ako zväčšiť veľkosť oblakov, aby boli ľahšie polarizované? Pridanie elektrónov, a preto musí mať jadro viac protónov a neutrónov, čím sa zvyšuje atómová hmota; alebo pridanie atómov do kostry molekuly, ktorá by zase zvýšila jeho molekulárnu hmotu.
Týmto spôsobom by jadrá alebo molekulárna kostra bolo menej pravdepodobné, že udržia elektronický oblak celý čas. Preto, čím väčšie sú zelené kruhy uvažované v A, B a C, tým viac polarizovateľné budú a väčšie budú aj ich interakcie londýnskych síl.
Tento účinok je jasne pozorovaný medzi B a C a môže to byť ešte viac, ak by kruhy mali väčší priemer. Toto zdôvodnenie je kľúčom k vysvetleniu fyzikálnych vlastností mnohých zlúčenín v závislosti od ich molekulárnych hmôt.
Príklady londýnskych síl
 Prírodný príklad londýnskych síl: nohy Gecos
Prírodný príklad londýnskych síl: nohy Gecos V prírode
V každodennom živote existuje nespočetné množstvo príkladov londýnskych disperzných síl bez toho, aby sa v prvom rade muselo pustiť do mikroskopického sveta.
Jeden z najbežnejších a najprekvapivejších príkladov sa nachádza v nohách plazov známych ako Gecos (vynikajúci obraz) a u mnohých hmyzu (tiež v Spiderman).
V nohách majú niektoré podložky, z ktorých vynikajú tisíce malých vlákien. Na obrázku môžete vidieť geco pózujúce na svahu skaly. Na dosiahnutie tohto cieľa využíva intermolekulárne sily medzi skalou a vláknami nôh.
Každá z týchto vlákien slabo interaguje s povrchom, cez ktorý sa malý plaz. Gecos sú tiež schopné vyliezť hladké a dokonalé povrchy, ako sú povrchy kryštálov.
Môže vám slúžiť: draselný nitri (KNO2): Štruktúra, vlastnosti a použitiaZatvoriť
Alkány sú nasýtené uhľovodíky, ktoré tiež interagujú londýnskymi silami. Jeho molekulárne štruktúry jednoducho pozostávajú z uhlíkov a hydrogénov zjednotených jednoduchými väzbami. Pretože rozdiel v elektronegativite medzi C a H je veľmi malý, sú to apolárne zlúčeniny.
Takto metán, cho4, Najmenší uhľovodík zo všetkých, vrie na -161.7. c. Keď sa do kostry pridáva C a H, získavajú sa ďalšie alkány s vyššími molekulárnymi hmotami.
Týmto spôsobom vzniká etán (-88.6. c), bután (-0.5. c) a oktán (125.7. c). Všimnite si, ako sa ich body varu zvyšujú, keď sú alkány ťažšie.
Je to preto, že ich elektronické oblaky sú polarizovateľnejšie a ich štruktúry majú väčšiu povrchovú oblasť, ktorá zvyšuje kontakt medzi ich molekulami.
Oktán, hoci je to apolárna zlúčenina, má bod varu väčší ako bod vody.
Halogény a plyny
Londýnske sily sú tiež prítomné v mnohých plynných látkach. Napríklad n molekuly2, H2, Co2, F2, Cl2 A všetky ušľachtilé plyny interagujú cez tieto sily, pretože majú homogénne elektrostatické rozdelenie, ktoré môžu trpieť snímkou a viesť k polarizácii.
Nobesné plyny sú on (hélium), neón (neón), AR (argon), KR (Kripton), XE (Xenon) a RN (Radon). Zľava doprava sa ich body varu zvyšujú so zvýšením atómových hmotností: -269, -246, -186, -152, -108 a -62 ° C.
Halogény tiež interagujú cez tieto sily. Fluór je plyn pri izbovej teplote, rovnako ako chlór. Bromín s väčšou atómovou hmotnosťou je v normálnych podmienkach, ako je červenkastá tekutina a jód, končí, tvorí fialovú pevnú látku, ktorá rýchlo sublimuje, pretože je ťažšia ako ostatné halogény.
Odkazy
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie.). Cengage Learning, P 452-455.
- Angeles Méndez. (22. mája 2012). Disperzné sily (z Londýna). Získané z: chémie.LAGUIA2000.com
- Londýnske disperzné sily. Získané z: Chem.Purdue.Edu
- HelMestine, Anne Marie, PH.D. (22. júna 2018). 3 typy intermolekulárnych síl. Zotavené z: Thoughtco.com
- Ryan Ilagan a Gary L Bertrand. Londýnske disperzné interakcie. Prevzaté z: chem.Librettexts.orgán
- Chempages nórials. Londýnske sily. Získané z: Chem.Wisc.Edu
- Kamereon. (22. mája 2013). Salamanqueas: Geco a sily Van der Waals. Získané z: Almabiologica.com

