Slabá kyselina
- 5055
- 877
- Václav Višňovský
 Príklady slabých kyselín
Príklady slabých kyselín Čo je slabá kyselina?
Slabá kyselina je tá, ktorá má vo vodnom roztoku malú kapacitu na disociáciu vodíka (H+) av jeho zodpovedajúcej konjugovanej základni. Na rozdiel od silných kyselín, ktorých disociácia je úplná (100%) a prakticky ireverzibilné, sú slabé kyseliny sotva disociované a reverzibilné.
Preto slabá kyselina generuje menej honov h+ Vo vode toho, čo by sa očakávalo. Medzi najreprezentatívne slabé kyseliny máme kyselinu octovú, hlavnú zložku octu, ktorá je približne v 0.5 % za normálnych podmienok.
To znamená, že najväčší podiel roztoku kyseliny octovej vo vode, ako je 5%varenie octu, je vo forme neotáčanej (CH3Cooh); Zatiaľ čo malá časť sa nachádza ako konjugovaná základňa (vyberte si3Coo-), sprevádzané H iónmi+, alebo presnejšie, h ióny3Ani+.
Potom, keďže množstvo vodíka, ktorý sa uvoľňuje slabá kyselina vo vodnom roztoku, je nízka, pH, ktoré produkujú, je vyššie (základné) ako množstvo produkované silnou kyselinou. Napríklad ocot má pH 2.5, pomarančový džús pH 3.3. 4.2 a 2 citrónová šťava z 2.
Tieto pH, hoci sú kyslé, sú vyššie ako pH, ktoré produkujú roztok silnej kyseliny (HCl, h2SW4, atď.), že môžu dosiahnuť hodnotu 1 alebo menej (záporné hodnoty pH).
Charakteristiky slabých kyselín
PH vašich riešení
Slabé kyseliny majú zvyčajne pH medzi 2.0 a menej ako 7.0, takže otáčajú farbu panenského papiera v červenej farbe. Tieto hodnoty pH sú oveľa vyššie ako hodnoty pH produkované silnými kyselinami, aj keď existujú výnimky.
Napríklad roztok kyseliny chlorovodíkovej 1 mM (silná kyselina) má pH 3.0, zatiaľ čo 1 mM roztok kyseliny fluórickej („slabá“ kyselina) má pH 3.2, ktorý je blízko k silnej kyseline.
Čiastočná ionizácia
Slabé kyseliny v roztoku sú ionizované malé alebo čiastočne vo vode, disociujú sa v konjugovanej základni kyslých a vodíkových iónov. Potom je slabá kyselina vo vodnom roztoku väčšinou disociovaná, s malým disociovaným pomerom.
Môže vám slúžiť: Vyváženie chemických rovnícAk je množstvo vodíka uvoľňovaného slabinou kyselinou vo vode nízke, pH produkované touto kyselinou je vyššie ako množstvo produkované silnou kyselinou rozpustenou vo vode, pretože sú zvyčajne ionizované 100 %.
Reverzitná ionizácia
Ionizácia slabej kyseliny je zvyčajne schematizovaná takto:
Má ⇌ a- + H3Ani-
Kde je slabá kyselina, do- jeho konjugovaná základňa a h3Ani+ katión Hydronium, ktorý je cestou v h+ Existuje alebo sa prejavuje vo vode. Koncentrácia (alebo aktivita) h3Ani+ Používa sa namiesto h+ Na stanovenie roztoku roztoku.
Ionizácia
Niektoré kyseliny sú slabšie ako iné, čo je rovnaké, že sú menej ionizované. Preto stupeň ionizácie nám umožňuje nahliadnuť do toho, aká kyslá je za určitých podmienok.
Aby sa vyjadril stupeň ionizácie, bolo zavedených niekoľko parametrov, ako je ionizácia alebo konštanta kyslosti (KA) a PKA: spôsob vyjadrenia KA v jednoduchom čísle, ktoré vynecháva použitie čísla vyjadreného v záporných silách desať (10 ), ako existuje v KA.
Konštanty KA a PKA sa používajú hlavne pre slabé kyseliny.
Ka = [a-] [H+] / [Ha]
Zátvorky prítomné vo vzorci predstavujú koncentrácie.
pka = - log ka
Hodnota PKA slabej kyseliny sa zvyčajne pohybuje medzi 2 a 12. Existujú však výnimky. Napríklad: a a odagická kyselina (hio3) má PKA 0.77, ktorý sa považuje za relatívne malú hodnotu, ale bez toho, aby bola negatívna, pre slabú kyselinu v prísnom zmysle.
Konjugovaná základná stabilita
Slabé kyseliny majú silnú väzbu s atómom kyslého vodíka (HΔ+-XΔ-), takže majú nízky stupeň disociácie vodíka. To má za následok konjugovanú základňu slabej kyseliny, má veľkú aviditu vodíkom, čo je silnou konjugovanou bázou.
Môže ti slúžiť: koloidTo znamená, že konjugovaná základňa slabej kyseliny je veľmi nestabilná, pretože akceptuje h+ veľmi ľahko sa vrátil. Čím nestabilnejšia táto konjugovaná báza, tým slabšia bude kyslá kyslá.
Nízka iónová vodivosť
Keďže sú malé ionizované, slabé kyseliny sú zlé vodiče elektriny, na rozdiel od silných kyselín, ktoré sú dobrými vodičmi elektriny.
Prítomnosť v prírode
Slabé kyseliny sú široko distribuované v prírode, napríklad sú v citrusových ovociach (citrón, grapefruity, oranžová atď.).
Sú tiež prítomné v mnohých procesoch, ktoré sa vyskytujú u všetkých živých bytostí. Niektoré z týchto biologických slabých kyselín sú pyruvické, mliečne, citrické, fumarické, sukcinické, glutamové atď., a dokonca aj okysličený hemoglobín uvoľňuje vodíny, takže sa správa ako slabá kyselina.
Potom možno dospieť k záveru, že človek žije v trvalom kontakte so slabými kyselinami.
Ako vypočítať pH slabej kyseliny?
PH slabej kyseliny sa môže vypočítať pomocou kyslej konštanty (KA) alebo pomocou Henderson-Haselbalchovej rovnice. V prvom príklade sa použije ka.
S kyslosťou konštantou
Vypočítajte pH roztoku 0.5 m kyseliny benzoovej (C6H5CoOH), ktorý má ionizačnú konštantu (ka) = 1.8 x 10-5
C6H5Cooh ⇌ c6H5Coo- + H+ (1)
Ak sa množstvo kyseliny, ktorá sa disociuje, nazýva x, potom 0.5 M-X bude koncentrácia slabej kyseliny, ktorá nie je disociovaná v rovnováhe, pričom x koncentrácia konjugátovej bázy kyseliny benzoovej a koncentrácie vodíkových iónov.
Rovnica (1) môže byť reprezentovaná takto:
0.5 m-x ⇌ x +x
Slabé kyseliny sú ionizované vo veľmi nízkom pomere, takže koncentrácia kyseliny benzoovej v rovnováhe (0.5 m-x), dá sa predpokladať ako 0.5 m, od x <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5 m
X2 = (1.8 x 10-5) (0.5 m)
X = 3 x 10-3 M
Preto [h+] sa rovná 3 x 10-3 M. Potom vyriešime výpočtom pH:
Môže vám slúžiť: Mohr Metóda: Základy, reakcie, postup, použitiepH = - log [h+]
= - denník [3 x 10-3]
pH = 2.52
Všimnite si, že pH je relatívne kyslé, pretože sa nachádza pod 3 alebo 4.
S Henderson-Haselbalchovou rovnicou
Henderson-Haselbalchova rovnica sa používa na výpočet pH roztoku pufra:
pH = pKa + log [konjugovaná báza] / [kyselina]
Príklad:
Hydroxid sodný (NaOH) sa pridáva do roztoku kyseliny octovej, ktorá produkuje konečnú koncentráciu kyseliny octovej (CH3Cooh) 1.11 x 10-2 Mol/L a konjugátová základňa koncentrácie (vyberte3Coo-) z 0.44 x 10-2 mol/l. Ak je PKA kyseliny octovej 4 4.75 Vypočítajte pH roztoku.
pH = 4.75 +denník [a-] / [Ha]
pH = 4.75 +protokol (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
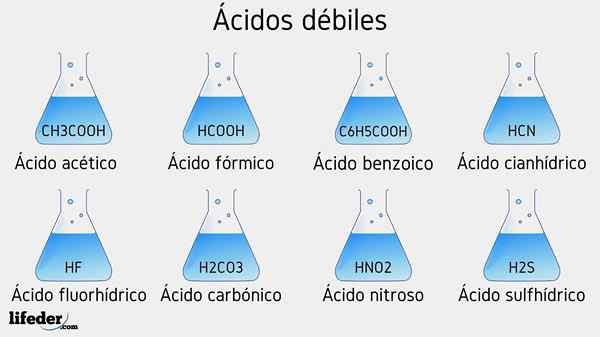
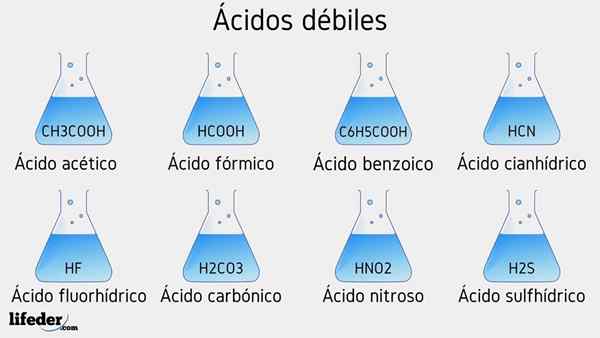
Príklady slabých kyselín
Nižšie bude uvedených niekoľko slabých kyselín sprevádzaných ich hodnotami PKA:
- Chvály3COOH (kyselina octová), PKA 4.75
- HCOOH (kyselina mravčová), PKA 3.74
- C6H5COOH (kyselina benzoová), PKA 5.59
- Chvály2Clcooh (kyselina chlóroctová), pka 2.85
- HCN (kyselina cyanhydrová), PKA 9.31
- HF.17
- C2H5COOH (kyselina propiónová), PKA 4.89
- Hned2 (Kyselina dusná), PKA 3.35
- H2S (kyselina sulfid), PKA1 6.0 a pka2 12.92
- Ccl3COOH (kyselina trichlóroctová), PKA 0.52
- H2Co3 (kyselina uhličitá), PKA1 6.37 a pka2 10.22
- H3Po4 (Kyselina fosforečná), PKA1 2.12, pka2 4.21 a pka3 jedenásť.0
- C6H5SW3H (kyselina benzefónová), PKA 0.70
- Hio3 (Kyselina yodná), PKA 0.77
- HCLO2 (Kyselina chlór), PKA 2.0
- Chvály3Chvály2(OH) COOH (kyselina mliečna), PKA 3.08
Slabé kyseliny s terapeutickým použitím
- Kyselina salicylová, PKA 3.00
- Kyselina acetylsalicylová, pka 3.49
- Furosemid, pka 3.90
- Ibuprofen, pka 4.40
- Levodopa, pka 2.30
- Phenobarbital, PKA 7.40
- Warfarina, pka 5.0
- Teofilina, pka 8.80
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Morris, J. G. (1974). Fyzikálna konanie pre biológov. (2. vydanie.). Obrátil som sa.
- HelMestine, Anne Marie, PH.D. (29. augusta 2020). Slabá definícia kyseliny a príklad v chémii. Zotavené z: Thoughtco.com
- Ophardt C., & McCarthy L. (15. augusta 2020). Kyslá a základná sila. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Clark Jim. (2013). Silná a slabá kyselina. Získané z: Chemguide.co.Uk
- Učenie lúmenu. (s.F.). Chémia pre nevýznamov: Výpočet pH slabých a základných roztokov. Uzdravené z: kurzov.Lumenarning.com

