Štruktúra Berkelio (BK), vlastnosti, získanie, použitia

- 1437
- 24
- Alan Milota
On berkelium Je to chemický prvok, ktorého symbolom je BK. Patrí do triedy aktinidov, ktorá je jej ôsmym členom. Vaše atómové číslo je 97. Je to syntetická kovová tuhá látka. Tento prvok sa nenachádza prirodzene nad zemskou kôrou. Je prítomný v malom množstve v vyhorených jadrových palivách a má strieborný lesk.
V prostredí sú tiež rozptýlené malé množstvá v dôsledku testov jadrových zbraní v dôsledku závažných nehôd v atómových energetických zariadeniach, ako je Černobyl a uvoľňovaním, ktoré sa vyskytuje z odpadu z jadrových energetických závodov.
 Symbol, číslo a atómová hmota prvku Berkelio. Zdroj: ME/CC By-S (https: // creativeCommons.Org/licencie/By-SA/2.5). Zdroj: Wikimedia Commons.
Symbol, číslo a atómová hmota prvku Berkelio. Zdroj: ME/CC By-S (https: // creativeCommons.Org/licencie/By-SA/2.5). Zdroj: Wikimedia Commons. Praktická užitočnosť pre Berkelio nebola nájdená, pretože sa vyskytuje vo veľmi malých množstvách a skutočnosť, že všetky jeho izotopy (atómy BK s rôznym počtom neutrónov v jadre) sú rádioaktívne. Jeho hlavná aplikácia bola vo vedeckých štúdiách.
Aj keď sú ich izotopy umelo vyrábané v špeciálnych laboratóriách a ich riešia odborní pracovníci, škody, ktoré by nebezpečné vyžarovalo, by sa malo vždy brať do úvahy.
[TOC]
Menovanie
- Berkelio, symbol BK.
- Berkelio-243, BK-243 alebo 243BK: Berkelio izotop s atómovou hmotnosťou 243.
Objavenie
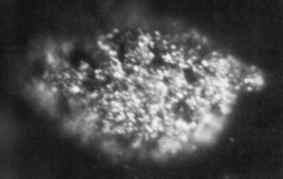 1,7 mikrofotografie mikrogramov tuhých kovov Berkelio získané v roku 1969. Národné laboratórium Oak Ridge, Ministerstvo energetiky / verejnej domény USA. Zdroj: Wikimedia Commons.
1,7 mikrofotografie mikrogramov tuhých kovov Berkelio získané v roku 1969. Národné laboratórium Oak Ridge, Ministerstvo energetiky / verejnej domény USA. Zdroj: Wikimedia Commons. Prvýkrát to vyrobil v roku 1949 vedci Glen Seaborg, Stanley G. Thompson a Al Ghiorso na Berkeley University v Kalifornii, keď bombardovali Amerio-241 s vysokoenergetickými alfa časticami pomocou cyklotrónu (urýchľovač častíc).
Ihneď po ožarovaní bol materiál náležite rozpustený a prešiel cez kolón iónovej výmennej živice, pričom ako eluent použil roztok citrátu amónneho.
Týmto spôsobom získali izotop prvku číslo 97 s 243 atómovou hmotnosťou, ktorá vyžaruje alfa častice a má polovicu života 4,5 hodiny.
Názov prvku
Spočiatku niekoľko výskumných pracovníkov navrhlo, aby prvok prevzal názov jedného z jeho objaviteľov Glen Seaborg, pretože mal výhodu, že sa mu podarilo syntetizovať 10 prvkov za niekoľko rokov práce.
Môže vám slúžiť: kadičkaOficiálna organizácia Medzinárodná únia čistej a aplikovanej chémie alebo IUPAC (skratka pre angličtinu Medzinárodná únia čistej a aplikovanej chémie) sa rozhodol priradiť meno „Berkelio“ za získanie na univerzite a meste Berkeley (Kalifornia).
 Vzhľad oblasti University of Berkeley v Kalifornii. Autor: Sarangib. Zdroj: Pixabay.
Vzhľad oblasti University of Berkeley v Kalifornii. Autor: Sarangib. Zdroj: Pixabay. Názov Berkeley pochádza z filozofa Angloirlandés George Barkeley, meno, ktorého výslovnosť sa potom zmenila v Spojených štátoch, keď bolo mesto a univerzita založené v roku 1869.
To bol náhodne rok, keď Dmitri Mendeléyev zverejnil svoj prvý periodický stôl a začal predpovedať existenciu nových prvkov ako Berkelio.
Elektronická štruktúra
Jeho elektronická konfigurácia je:
1siež2; 2siež2 2p6; 3siež2 3p6 3d10; 4siež2 4p6 4d10 4F14; 5siež2 5p6 5d10; 6siež2 6p6; 5F9 7siež2,
alebo kompaktné:
[Rn] 5F9 7siež2.
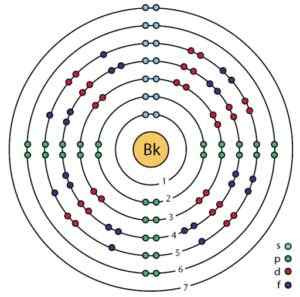 Elektronická štruktúra Berkelio. Orbitály a elektróny sú vidieť. Breh.ScienceWriter/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Elektronická štruktúra Berkelio. Orbitály a elektróny sú vidieť. Breh.ScienceWriter/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Získanie
Prvá vzorka kovu bola pripravená v roku 1969 prostredníctvom reakcie na redukciu fluoridu (BKF3) S kovom lítia (Li) pri teplote 1300 K.
Na prípravu tenkých kovových listov sa oxid BKO zníži2 S Torio (TH) alebo kovovým lantano.
Berkelioove fyzické vlastnosti
Fyzický stav
Kovová pevná látka.
Berkelio Metal má dve kryštalické formy: alfa (dvojité kompaktné šesťuholník) a beta (kubické sústredené na tvári).
Atómová hmota
247
Bod topenia
1050 ° C (alfa forma)
986 ° C (forma beta)
Bod varu
2627 ° C
Hustota
14,78 g/cm3 (alfa forma)
13,25 g/cm3 (forma beta)
Paramagnetizmus
Podľa niektorých zdrojov niektoré zlúčeniny Berkelio ukazujú paramagnetické vlastnosti, čo znamená, že sú priťahované k magnetickým poliam.
Táto charakteristika je paramagnetického typu, pretože pri suspendovaní magnetického pôsobenia materiál nedokáže takéto vlastnosti udržiavať sám.
Chemické vlastnosti
Pri vysokých teplotách je kovový berkelio rýchlo oxidovaný vo vzduchu alebo kyslíku, čím sa vytvára jeho oxidy. Je ľahko rozpustný v minerálnych kyselinách a uvoľňuje plynný vodík H2 a formovanie BK iónov3+.
Môže vám slúžiť: hydrid hliníka (ALH3): štruktúra, vlastnosti, použitiaOxidačné stavy
Počiatočné výskumy tohto prvku boli obmedzené na experimenty na výmenu iónov a koprecipitácie, s ktorými sa zistilo, že oxidačný stav +3 je stabilný a +4 je prístupný vo vodnom roztoku, pretože BK3+ Môže byť oxidovaný bromato iónom (brácho4-) Dať BK4+.
Stabilizácia BK4+
V roku 2017 bola hlásená stabilizácia BK4+ V roztoku s použitím zlúčeniny vytvorenej hydroxipiridinónovými skupinami spojené s polyamínovou štruktúrou (nazývanou ligand 3,4,3-li (1,2-hop)).
Táto zlúčenina má osem miest, kde sa ión spája, ktoré zodpovedajú atómom kyslíka skupín C = O a N-OH, čo zanecháva BK4+ pevne spojený s ligandom, zostáva stabilný.
Tuhé zlúčeniny
BK4+ môže kopreciditovať s cerio (CE4+) alebo zirkónia (ZR4+) vo fosforečnanom alebo yodato. Môže sa tiež extrahovať v bis hexánových roztokoch (2-etylhexil) hydrogenofosforečnanu alebo iné podobné ústretové činidlo.
Prvou zlúčeninou Berkelio, ktorá sa vyskytla vo viditeľných množstvách, bol chlorid (BKCL3), z ktorých sa v roku 1962 získalo 0,000000003 gramov. Odvtedy bolo niekoľko zlúčenín Berkelio schopných pripraviť sa a študovať.
Môžu byť uvedené napríklad fosfát (BKPO4), oxychlorid (BKocl), fluoridy (BKF3 a bkf4), Oxid (BKO2), oxid (BK2Ani3), Yodatos (bk (io3)3 a bk (io3)4), Chlórhydrát [BKCL2(H2Buď)6] CL, oxalát, organometistické zlúčeniny a koordinačné zlúčeniny, okrem iného.
Nový oxidačný stav +5
V roku 2018 sa skupine vyšetrovateľov z niekoľkých krajín podarilo vyrobiť dusičnanský komplex s Pentavalent Berkelio (BK5+) ktorého vzorec je bko2(Nie3)2-, odstránením dvoch molekúl2 bk iónov (nie3)4-, (BK3+).
Výpočty výpočtovej energie potvrdili, že oxidačný stav +5 je ten, ktorý má najväčšiu stabilitu v tomto komplexe dusičnanov Berkenilo, preto je najpravdepodobnejší.
Izotopy
Z Berkeliu bolo syntetizovaných 14 izotopov s atómovými masami od 238 do 251. Všetky sú rádioaktívne.
Môže vám slúžiť: Benchilo: benzylové hydrogény, karbocations, benzylové radikályNajstabilnejší je Berkelio-247, ktorého polčas je 1380 rokov. Každý atóm tohto izotopu pri rozpadu emituje alfa častice a tvorí atóm Ameriky-243.
BK-249 má polčas 330 dní, trpí beta rozpad a stáva sa Californio-249.
Žiadosti
Keďže boli schopní získať iba veľmi malé množstvá tohto prvku, používa sa iba v základnom vedeckom výskume.
Pri získavaní ťažších prvkov
Izotop BK-249 má relatívne dlhý polčas a je to možné.
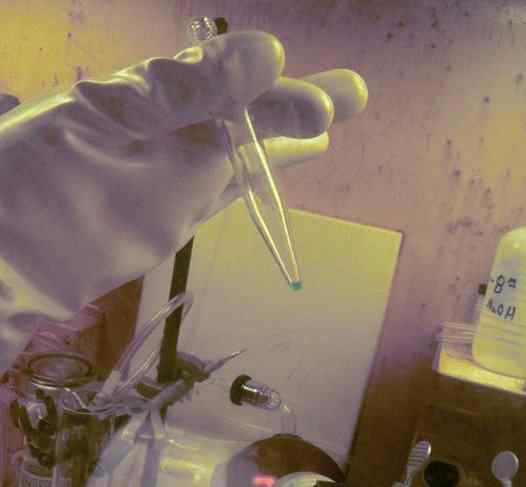 BK mikrokantita rozpustená v skúmavke. Na jeho získanie sa použilo 250 dní. Je možné pozorovať rukavice na ochranu rádioaktivity tohto prvku. ORNL, ministerstvo energetiky / verejnej domény. Zdroj: Wikimedia Commons.
BK mikrokantita rozpustená v skúmavke. Na jeho získanie sa použilo 250 dní. Je možné pozorovať rukavice na ochranu rádioaktivity tohto prvku. ORNL, ministerstvo energetiky / verejnej domény. Zdroj: Wikimedia Commons. Vo fyzikálno -chemických štúdiách
Výskum uskutočnený s BK umožňuje presnejšie extrapolácie týkajúce sa vlastností a správania iných prvkov, ktoré nasledujú v hereckej sérii, pretože najťažšie prvky je ťažšie získať, majú veľmi krátke priemerné životy a sú oveľa viac rádioaktívne.
Riziká
Berkelio je rádioaktívny prvok. Uvoľňovanie rádioaktivity v prostredí môže osloviť všetky druhy zvierat a rastlín, čo im spôsobí poškodenie. Zhoršenie sa môže hromadiť v nasledujúcich generáciách.
 Rastliny jadrovej energie sú rádioaktívne, a preto veľmi nebezpečné. Autor: AR130405. Zdroj: Pixabay.
Rastliny jadrovej energie sú rádioaktívne, a preto veľmi nebezpečné. Autor: AR130405. Zdroj: Pixabay. Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Berkelium - BK (prvok). Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Biela, f.D. a kol. (2019). Súčasná chémia Berkelium a kalifornia. Chémia 2019 6. augusta; 25 (44): 10251-10261. Získané z PubMed.Ncbi.NLM.NIH.Vláda.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Kelley, m.P. a kol. (2018). Bond Covalecy a Oxidačný stav aktinidu komplexovaný s terapeutickým chelatačným činidlom 3,4,3-Li (1,2-hopo). Inorg. Chem. 2018 7. mája; 57 (9): 5352-5363. Získané z PubMed.Ncbi.NLM.NIH.Vláda.
- KOVACS, a. a kol. (2018). Pentavalent Curium, Berkelium a California v dusičnanom: Rozšírenie aktinidových chémie a oxidačných stavov. Chem. 2018 6. augusta; 57 (15): 9453-9467. Získané z PubMed.Ncbi.NLM.NIH.Vláda.
- Orlova, a.Jo. (2007). Chémia a štrukturálna chémia bezvodých tri- totravalentných aktinidových ortofosfperov. V štrukturálnej chémii anorganických aktinidových zlúčenín. Zotavené z vedeckých pracovníkov.com.
- Osekávanie. a kol. (2013). Prvky aktinidu a transaktinidu. V rádiochémii a jadrovej chémii (štvrté vydanie). Zotavené z vedeckých pracovníkov.com.
- Peterson, J.R. a Hobart, D.A. (1984). Chémia Berkelium. Pokroky Anorganic Chemistry, zväzok 28, 1984, strany 29-72. Zotavené z vedeckých pracovníkov.com.
- Kráľovská spoločnosť chémie. (2020). Berkelium. RSC obnovil.orgán.

