Štruktúra jodidu olovo, vlastnosti, získanie, použitie, použitia

- 2723
- 757
- JUDr. Rudolf Čapkovič
On Jodid Je to anorganická zlúčenina tvorená hlavným prvkom (PB) v jeho oxidácii +2 a jód (i) s Valencia -1. Jeho chemický vzorec je HDP2. Je to toxická zlúčenina. Pretože to vedie, je škodlivý pre človeka, zvieratá a prírodné ekosystémy. Okrem toho môže jodid tiež spôsobiť niektoré choroby.
HDP zlúčenina4, To je, s olovom v oxidácii +4, sa zdá, že neexistuje, pravdepodobne v dôsledku redukčnej kapacity jodidového iónu (i-). HDP2 Je to pevná žltá farba malá rozpustná vo vode.
 Olovo jodid (HDP2). W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Olovo jodid (HDP2). W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Môže sa získať pomocou iónovej výmennej reakcie medzi jodidovou soľou a olovom, ktorý je rozpustný vo vode.
Má polovodičové vlastnosti, takže väčšina svojich súčasných aplikácií je vo fotovoltaických zariadeniach, detektoroch určitého žiarenia a senzorov.
Jedným z najviac študovaných použití tejto zlúčeniny je použitie solárnych článkov Perovskita, ktoré sa ukázali ako veľmi účinné a nízke náklady.
[TOC]
Štruktúra
V olovnom jodide je spojenie medzi jeho atómami iónne iba čiastočne. Atómy tvoria vrstvy so šesťuholníkovou štruktúrou a sú navzájom spojené slabými silami Van der Waals.
Tieto sily nie sú ani iónové, ani kovalentné, sú slabé interakcie medzi elektronickými vrstvami atómov.
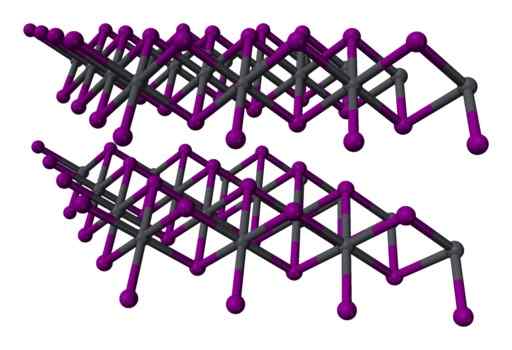 Štruktúra Two -Layer Tri -Layer2 kryštalický. Gray = olovo; Violet = jód. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons.
Štruktúra Two -Layer Tri -Layer2 kryštalický. Gray = olovo; Violet = jód. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons. Menovanie
- Jodid
- Olovo jodid (II)
- Diyoduro
- Plumboso jodid
Vlastnosti
Fyzický stav
Žiarivo žltá kryštalická pevná látka. Hexagonálne kryštály.
 Šesťuholníkové kryštály oloveného jodidu. Alessandro e Damiano/CC od (https: // creativeCommons.Org/licencie/o/4.0). Zdroj: Wikimedia Commons.
Šesťuholníkové kryštály oloveného jodidu. Alessandro e Damiano/CC od (https: // creativeCommons.Org/licencie/o/4.0). Zdroj: Wikimedia Commons. Molekulová hmotnosť
461 g/mol
Bod topenia
410 ° C
Bod varu
954 ° C, varte s rozkladom.
Hustota
6,16 g/cm3
Rozpustnosť
Ľahko rozpustné vo vode: 0,076 g/100 ml pri 25 ° C. Rozpustná horúca voda. Nerozpustné v alkohole a kyseline chlorovodíkovej (HCl).
Môže vám slúžiť: Sodík: História, štruktúra, vlastnosti, riziká a použitieChemické vlastnosti
Jeho oxidačné a redukčné vlastnosti sú slabé. Môžete však prezentovať oxedenukčné reakcie.
Aj keď je veľmi málo rozpustné vo vode, ktorá sa rozpúšťa v koncentrovaných roztokoch alkalických jodidov, ako je jodid draselný (KI). Je rozpustný v koncentrovanom roztoku octanu sodného (ch3Vrecko). Voľne sa rozpúšťa v roztoku tiosíranu sodného (NA2Siež2Ani3).
Niektorí autori naznačujú, že vo vode je možné generovať ión PBI+ A ak existuje prebytočný iónový ión (i-) je možné vytvoriť zložitejšie druhy, ako je HDP3- a HDP42-, okrem iného.
Nie je to horľavé.
Ďalšie fyzické vlastnosti
Správa sa ako polovodič, to znamená, že môže alebo nemusí vykonávať elektrinu v závislosti od podmienok, ku ktorým je vystavený.
Je to polovodič priama medzera, to znamená, že jeden z jeho elektrónov prechádza z pásma Valencia na jazdu, musí mať iba množstvo energie rovnajúcej sa zakázanej šírke pásma.
Kvôli vysokému atómovému počtu jeho prvkov (Pb = 82, i = 53) má vysokú fotoelektrickú kapacitu. Jeho 2,5 -vôbec priepasť umožňuje vysoko účinné fotovoltaické výkony pri teplotách až do 250 ° C.
Získanie
Môže sa pripraviť reakciou zlúčeniny rozpustnej vo vode s kyselinou iahydovou (HI) alebo s rozpustným kovovým jodidom. Napríklad je zmiešaný vodný roztok octanu oxa s jodidom draselným:
Pb (ch3Coo)2 + 2 KI → HDP2↓ + 2 K (zvoľte3Coo)
Tento typ reakcie je známy ako „výmena iónov“, pretože katióny a anióny sa vymieňajú medzi soľami.
V uvedenom príklade je octan draselný vo vode veľmi rozpustný a zostáva rozpustený, zatiaľ čo jodid draselný, ktorý je menej rozpustný, zráža a filtruje. Čistenie sa vykonáva rekryštalizáciou zlúčeniny vo vode.
Môže vám slúžiť: kryštalizáciaZrážanie PBI2 Je vidieť na nasledujúcom obrázku, ktorý zobrazuje skúmavku, kde dusičnan olovo (II) (PB (nie3)2) a jodid draselný (KI) vo vodnom roztoku. Tento efekt sa nazýva „zlato zlata“.
 Dážď zlata z HDP2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Dážď zlata z HDP2. Stefano SCT/CC BY-S (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Žiadosti
Ako polovodič
Používa sa ako detektor pre vysokoenergetické fotóny, ako sú X -Rays a Gamma Rays. Môže sa používať vo fotovoltaických zariadeniach, fotobulkách, LED svetlách, optických detektoroch a v biologickej klasifikácii a senzoroch.
Ak je zavedený do nanoštruktúr, môže sa použiť pri fotokatalýze a solárnych článkoch. Okrem toho veľa nanočastíc HDP2 Majú luminiscenčné vlastnosti.
 Olovo jodid sa používa v lekárskych detektoroch X -Ray. Autor: LKCJJANG40090. Zdroj: Pixabay.
Olovo jodid sa používa v lekárskych detektoroch X -Ray. Autor: LKCJJANG40090. Zdroj: Pixabay. Solárne bunky
HDP2 Je sprostredkovateľom v syntéze Perovskitas určených pre solárne články. Tento typ fotovoltaických buniek obsahuje metylamónium a jodid olovo (vyberte3NH3HDP3) Na základe strýka2.
Takéto zariadenia majú vysokú účinnosť a nízke náklady, takže boli veľa štúdia a výskumu.
 Solárne články na streche domu v teréne. Solárne články, v ktorých sa používa PBI2 Sú veľmi efektívne a nie sú príliš drahé, takže by sa mohli v budúcnosti používať v domoch. Autor: Manfred Antraranis Zimmer. Zdroj: Pixabay.
Solárne články na streche domu v teréne. Solárne články, v ktorých sa používa PBI2 Sú veľmi efektívne a nie sú príliš drahé, takže by sa mohli v budúcnosti používať v domoch. Autor: Manfred Antraranis Zimmer. Zdroj: Pixabay. Avšak od Cho3NH3HDP3 Môže sa rozobrať dažďovou vodou, bolo študované, ako znečisťujúce tieto bunky môžu byť tak, keď sa používajú, ako aj po vyradení.
CH3NH3HDP3 Po kontakte s vodou sa rozpadne na metylamín (vyberte3NH2), Kyselina yodhydrová a HDP2. Ten, hoci je vo vode málo rozpustný, v priebehu času môže uvoľňovať množstvá z toxických iónov PB2+.
Štúdie nie sú presvedčivé, pretože miesto, kde dôjde k uvoľňovaniu olova, aby sa určilo, či môže byť táto suma škodlivé v krátkodobom horizonte. Na druhej strane, pokračujúce uvoľňovanie môže bioakumulovať a byť veľmi nebezpečný.
Môže vám slúžiť: butanone: štruktúra, vlastnosti a použitiaOstatné aplikácie
- Je zasiate vo forme spreja v oblakoch, aby sa produkoval dážď.
- Vo filtroch na astronómiu vzdialeného infračerveného.
- Vo fotografii, dojmoch, filmoch na zaznamenávanie optických obrazov, fotografické emulzie.
- V brzdovom nátere. V mazivých tukoch.
- Ortuťové parné oblúkové žiarovky. Na elektrickom papieri.
- Termoelektrické materiály, tepelné batérie s jódom.
Riziká
Za bezpečnosť
Musí sa ukladať ďaleko od oxidantov, ako sú peroxidy, peroxidy, permangananáty, chlorórie a dusičnany. Malo by sa vyhnúť aj kontaktu s chemicky aktívnymi kovmi, ako je draslík, sodík, horčík a zinok. Vo všetkých týchto prípadoch môže dôjsť k násilnej reakcii.
Ak podstúpite zahrievanie, vytvárajú sa jedovaté plyny olova a jódu.
Do zdravia
Je veľmi škodlivý pre človeka. Potvrdilo sa, že je to karcinogén pre zvieratá, preto sa primerane odvodzuje, že je to tiež pre ľudskú bytosť.
Môže spôsobiť bolesť hlavy, podráždenosť, znížiť pamäť a rušiť spánok. Olovo obsiahnuté v tejto zlúčenine môže spôsobiť trvalé poškodenie obličiek, mozgu, nervov, krviniek a rizika vysokého tlaku.
Musí sa s ním zaobchádzať ako s teratogénom (zlúčenina, ktorá môže vygenerovať vrodenú defekt). Môže tiež produkovať jodizmus, ktorého príznaky sú preťažením nosných dierok, bolesti hlavy, podráždenie slizníc a kožnej erupcie.
Pre prírodné prostredie
Je klasifikovaný ako toxická znečisťujúca látka. Musí sa držať ďalej od zdrojov vody a odtoku. Aby sa predišlo kontaminácii hrádzí, by sa malo postaviť vždy, keď je potrebné ich udržať.
Je veľmi toxický pre vodný život s účinkami, ktoré trvajú v priebehu času, pretože je bioakumulovateľný.
Odkazy
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Alebo.Siež. Lekárska knižnica. (2019). Jodid. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Evstropiev; Siež.Klimatizovať. a kol. (2020). Syntéza a charakterizácia PVP/PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Odkaz obnovený.Prubár.com.
- Ismail, r.Do. a kol. (2016). Syntéza PBI2 Nanočastice laserovou abláciou v metanole. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Odkaz obnovený.Prubár.com.
- Materiál. (2013). Olovo jodid (HDP2) Polovodič. Zotavené z Azom.com.
- CDH (2008). Olovo (ii) jodid. Materiál s bezpečnostnými údajmi. Zotavené z chdfinethememického.com.
- Hailegnaw, b. a kol. (2015). Dážď na metylamónium olovo na báze perovskitov na báze jodidu: možné environmentálne účinky perovskitových solárnych článkov. J. Fyzický. Chem. Launt. 2015, 6, 9, 1543-1547. Získané z krčiem.ACS.orgán.
- Nadácia Wikimedia (2020). Olovo (ii) jodid. Získaný z.Wikipedia.orgán.
- « Štruktúra octanu, vlastnosti, získanie, použitie, použitia
- Organizácia objektívnej spoločnosti, štruktúra, príklad »

