Štruktúra octanu, vlastnosti, získanie, použitie, použitia

- 2159
- 357
- Alan Milota
On Octa o Acetát olovo (II) je zlúčenina tvorená oloveným iónom (PB2+) a dva acetátové ióny (ch3Coo-). Jeho chemický vzorec je (CHO3Coo)2PB alebo tiež PB (vyberte si3Coo)2.
Je tiež známy ako „olovený cukor“, pretože má sladkú chuť. Je to však veľmi jedovatá látka. Je to veľmi rozpustná kryštalická pevná látka vo vode. Môžete ľahko reagovať s sulfidom vodíka (h2S) Generovanie sulfidu olova (PBS), ktorý sa používa pri detekcii tohto toxického plynu v priemyselných procesoch.
 Pevný ocelca (ii) acetát. Dormoothemista v anglickom Wikipedia/CC od (https: // creativeCommons.Org/licencie/o/3.0). Zdroj: Wikimedia Commons.
Pevný ocelca (ii) acetát. Dormoothemista v anglickom Wikipedia/CC od (https: // creativeCommons.Org/licencie/o/3.0). Zdroj: Wikimedia Commons. V staroveku sa získala relatívne ľahké, takže použili, ktoré sú v súčasnosti úplne zakázané v dôsledku toxicity tejto zlúčeniny.
Prášok octanu by sa nemal rozptýliť v prostredí, pretože tvorí výbušné zmesi s kyslíkom. Okrem toho je to karcinogénna zlúčenina pre zvieratá a ľudí.
Sa absorbuje v organických tkanivách ľahšie ako iné olovené zlúčeniny. Má tendenciu bioakumulovať v živých bytostiach, takže by sa nemalo vyradiť do životného prostredia.
[TOC]
Štruktúra
Octu olovo (II) má štruktúru uvedenú na obrázku nižšie:
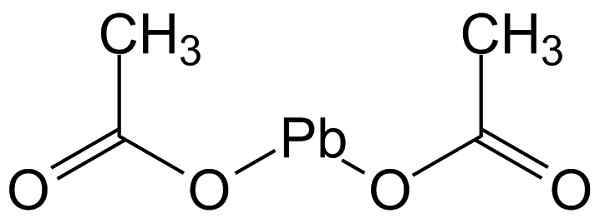 Molekulárna štruktúra octanu oloveného (II). Michał Sobkowski/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Molekulárna štruktúra octanu oloveného (II). Michał Sobkowski/CC BY-SA (https: // creativecommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Menovanie
- Octat (II)
- Diacetát
- Olovený etanoát
- Octat
- Olovnatý cukor
- Satur soľ
Vlastnosti
Fyzický stav
Kryštalické pevné bezfarebné až biele.
Molekulová hmotnosť
325 g/mol
Bod topenia
280 ° C
Bod varu
Nevarte. Rozpadá sa, keď je zahrievaný.
Hustota
3,25 g/cm3
Rozpustnosť
Veľmi rozpustné vo vode: 44,3 g/100 ml pri 20 ° C. Nerozpustný v alkoholu.
pH
Vodný roztok na 5% má pH 5,5-6,5.
Chemické vlastnosti
Keď PB (ococh3)2 Rozpúšťa sa vo vode, časť je ionizovaná takto:
Pb (ococh3)2 → PB2+ + 2 ch3Coo-
Časť molekúl však nie je ionizovaná a zostáva vo forme:
Chvály3Coo-PB-Ococh3.
Keď PB ión2+ Zadajte roztok čiastočne hydrolyzes vo vode generujúcej druhy PB4(Oh)44+.
Vodné roztoky acetátu Pb (II) acetát rozpustia oxid olova (PBO).
Môže vám slúžiť: ButenoReaguje s sulfidom vodíka (h2S) Vytvorenie hnedého olova sulfidu olova (PBS).
Pb (ococh3)2 + H2S → PBS + 2 ch3Kohútik
Ak sa pridá vodný roztok amoniaku (NH3) Biela zrazenina alebo biela acetátová tuhá látka základného acetátu sa tvorí na olovo octanového oxa.
Ďalšie vlastnosti
Emituje zápach podobnú vône octu. Má sladkú chuť. Jeho najbežnejšou komerčnou formou je trihydrát PB (ch3Coo)2 •3h2Ani.
 Trihydrát octanu. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Trihydrát octanu. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Získanie
Môže sa pripraviť rozpustením oxidu alebo uhličitanu oloveného (II) v koncentrovanej kyseline octovej. Môžu sa použiť aj malé tenké kovové olovené dosky.
PBO + 2 ch3COOH → (ch3Coo)2PB + H2Ani
Starodávne použitie
V medicíne
Použil sa v zriedenom roztoku na jeho aplikovanie ako obklady a premytý v zápaloch spôsobených jedovatým brečtanom a ako astringent v pleťoch. Tiež liečiť hnačky.
Pri veterinárnych ošetreniach
Pri liečbe povrchových zápalov a modrín sa použil ako adstringent a sedatívne mlieko.
Kozmetika
Bol vyrobený v starovekých rímskych časoch. Niektoré ženy to aplikovali na svoju tvár, aby sa zdali bledé, čo nebolo len módou, ale záležitosťou sociálneho postavenia.
Biela pleť naznačila, že žena nepatrí do robotníckej triedy, ale do najvyšších úrovní rímskej spoločnosti. A to sa stalo napriek tomu, že lekári času, ako napríklad Plinio El Viejo, poznali niektoré z jej škodlivých účinkov.
Ako sladidlo nápojov
Kvôli svojej sladkej chuti sa používa v staroveku ako náhrada cukru, najmä vo víne a osladenie a ochrana ovocia.
V niekoľkých aplikáciách
Niektoré z týchto použití sa stále uplatňujú, ale konzultovaná literatúra o tom nie je jasná:
- V chrómových pigmentoch, ako súčasť pri lepiacich farbách, v suchých organických mydlách pre maľby, laky a atramenty, ako je odpudzovanie vody, v protitvrdzovacích farbách.
- V procese získania zlata pomocou kyanidov na pokrytie kovov olovom.
- Ako mordant v bavlnených farbách, zložka fixovania kúpeľov na tlač papiera so slnečným žiarením.
- Ošetrenie markízy a vonkajšieho nábytku, a tak zabrániť odstraňovaniu činidiel, ktoré chránia pred poškodením plesní a dažďom.
Súčasné použitie
Pri detekcii H2Siež
V určitých priemyselných procesoch sa používa na detekciu toxického h2V plynných prúdoch prostredníctvom skúšobnej úlohy, v ktorej slúži ako ukazovateľ. Limit detekcie je 5 ppm (časti na milión).
 Octan olovo (II) umožňuje zistiť h2V priemyselných plynoch, aby sa tento toxický plyn nevydal do atmosféry. Autor: Leestilltaolcom. Zdroj: Pixabay.
Octan olovo (II) umožňuje zistiť h2V priemyselných plynoch, aby sa tento toxický plyn nevydal do atmosféry. Autor: Leestilltaolcom. Zdroj: Pixabay. V nedávnych testoch boli nanofibras začlenené spolu s polymérom, čo vedie k novému detekčnému materiálu, ktorý umožňuje prítomnosť 400 ppb (diely na miliardu) H2S dokonca vlhkosťou 90%.
Vysoký potenciál tohto nanomateriálu ako kolorimetrického snímača ho robí použiteľný na detekciu H2V dychu ľudí trpiacich halitózou, ktorých rozsah je pod 1 ppm.
 Nové nanovlákna obsahujúce PB (CH3Coo)2 Môžu zistiť veľmi malé množstvá H2S dychom. Autor: Natalia Ovcharenko. Zdroj: Pixabay.
Nové nanovlákna obsahujúce PB (CH3Coo)2 Môžu zistiť veľmi malé množstvá H2S dychom. Autor: Natalia Ovcharenko. Zdroj: Pixabay. Pri získavaní iných zlúčenín
Umožňuje pripraviť ďalšie olovené zlúčeniny, ako je uhličitan a chromát, olovené soli s vysokou molekulovou hmotnosťou a antioxidačné mastné kyseliny pre gumy.
Na externé použitie
Podľa niektorých konzultovaných zdrojov sa táto zlúčenina stále používa vo farbách vlasov, ktorých aplikácia Indikácie varujú, že by sa nemala používať v iných častiach tela odlišných od pokožky hlavy.
Je tiež súčasťou externého použitia analgetických výrobkov a ochrancov pokožky.
V obidvoch prípadoch však nie je dostatok dôkazov na preukázanie stupňa bezpečnosti týchto výrobkov, takže v krajinách ako Kanada av štáte USA bolo jeho používanie vo všetkých druhoch kozmetiky alebo na aplikáciu zakázané na pokožke.
Riziká
Za bezpečnosť
Nie je to palivo, ale je rozptýlené v prostredí vo forme jemných častíc môže generovať výbušné zmesi so vzduchom.
Mal by sa ukladať ďaleko od oxidačných zlúčenín, silných kyselín a chemicky aktívnych kovov av oblastiach bez odtokov alebo prístupu k kanalizáciám, ktoré vedú k odpadu.
Do zdravia
Môže dráždiť oči, dýchací trakt a trávenie, čo spôsobuje bolesť hlavy, nevoľnosť, zvracanie, koliku, svalovú slabosť, kŕče, záchvaty, ochrnutie, závraty, stratu vedomia, kómy a dokonca aj smrť.
Môže vám slúžiť: kyselina hyposulfurózneOctanové oxa sa absorbuje okolo 1,5 -krát rýchlejšie ako iné olovené zlúčeniny.
 Octanu octa negatívne ovplyvňuje mozog detí. Autor: Pete Lyforth. Zdroj: Pixabay.
Octanu octa negatívne ovplyvňuje mozog detí. Autor: Pete Lyforth. Zdroj: Pixabay. Veľmi nízke koncentrácie krvi u detí môže spôsobiť hyperaktivitu alebo neurokonduktuálne postihnutie, pretože vytvára účinky na nervový systém. Môže tiež produkovať anémiu a poškodenie obličiek.
V prípade zvierat bolo dostatočne dokázané, že je toxický pre reprodukciu, karcinogén a teratogénny. Odhaduje sa, že ľudské bytosti ovplyvňujú rovnakým spôsobom.
Pre životné prostredie
Považuje sa za nebezpečnú látku pre životné prostredie, pretože ide o toxickú znečisťujúcu látku. Je to veľmi škodlivé pre vodné organizmy. Osobitná pozornosť by sa mala venovať vtákom, cicavcom, znečisteniu pôdy a kvalitou vody.
Bioakumulácia tejto zlúčeniny v rastlinách a zvieratách sa môže vyskytnúť. Medzinárodné ekologické inštitúcie silne nedovolia vstúpiť do prostredia, pretože je pretrvávajúce.
Historický prípad otravy
Jednou z študovaných udalostí bola udalosť prezidenta Spojených štátov Andrew Jackson (1767-1845), ktorá podstúpila ošetrenie „oloveného cukru“, čo bolo v tom čase tradičným liekom s rôznymi účelmi.
V roku 1999 sa uskutočnili opatrenia na dve vzorky vlasov získané v živote prezidenta a zistilo sa, že hladiny olova boli veľmi vysoké v obidvoch vzorkách, čo je kompatibilné so symptómami inštalácie, ktoré utrpeli utrpenie.
 Andrew Jackson bol pod vplyvom alkoholu na základe olovených liekov. Autor: Gordon Johnson. Zdroj: Pixabay.
Andrew Jackson bol pod vplyvom alkoholu na základe olovených liekov. Autor: Gordon Johnson. Zdroj: Pixabay. Ich listy aj ich životopis opisujú, že okrem iného prezentovali príznaky ako nevoľnosť, brušné kŕče a paralytický reumatizmus. Ale po chvíli Jackson opustil liečbu octanulého oxa, takže sa jeho zdravie zlepšilo.
Preto sa odhaduje, že jeho smrť pravdepodobne nebola spôsobená otravou olovom.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Octan. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Ghazi, a.M. a Millette, J.R. (1964). Viesť. Octa. V forenznom prostredí. Zotavené z vedeckých pracovníkov.com.
- MUSHAK, P. (2011). Vedenie a verejné zdravie. V stopových kovoch a kontaminantoch v závideniach. Zotavené z vedeckých pracovníkov.com.
- Cha, J.-H. a kol. (2018). Subs-diela-za milión sulfidu sulfidu vodíka: kolorimetrický senzor: olovo vyvolané nanovláknami na diagnostiku halitózy. Anal Chem 2018 7. augusta; 90 (15): 8769-8775. NCBI sa zotavila.NLM.NIH.Vláda.
- Nadácia Wikimedia (2020). Octan. Získaný z.Wikipedia.orgán.
- Stewart, s. (2015). „Žiariaci a smrtiaci biely“. Spravodlivá pleť. V histórii toxikológie a zdravia životného prostredia. Zotavené z vedeckých pracovníkov.com.
- Deppisch, l.M. a kol. (1999). Vystavenie Andrewa Jacksona voči ortuti a oloveniu: otrávený prezident? Jama 1999 11. augusta; 282 (6): 569-71. NCBI sa zotavila.NLM.NIH.Vláda.
- « Štruktúra dusičnanu olovo, vlastnosti, získanie, použitia
- Štruktúra jodidu olovo, vlastnosti, získanie, použitie, použitia »

