Vlastnosti, štruktúra, použitia oxidu chlóru (V)

- 2381
- 699
- Denis Škriniar
On Oxid chlóru (V) Je to vysoko nestabilná anorganická zlúčenina, ktorej chemický vzorec je CL2Ani5. Je to jeden z mnohých oxidov chlóru, ktoré sa vyznačujú molekulárnymi alebo dokonca radikálnymi druhmi.
Cl2Ani5 Našiel život iba na papierových a teoretických výpočtoch; Jeho existencia však nebola vylúčená a je pravdepodobné, že niektoré sa dajú charakterizovať (pokročilými technikami spektroskopie)). Čo sa týka všeobecných konceptov chémie, možno predpovedať tento oxid, je to, že je to anhydrid kyseliny chlorovej, HCLO3.
 Molekula CL2O5. Zdroj: Jynto [CC0].
Molekula CL2O5. Zdroj: Jynto [CC0]. Hypotetická molekula oxidu chlóru (V) je uvedená vyššie (V). Všimnite si, že pretože ide o molekulu, prítomnosť CL+5; Ešte menej, keď musí mať takú polarizačnú silu na vynútenie kyslíka, spájajúc kovalentne.
Rovnako ako každá nestabilná zlúčenina, uvoľňuje energiu na rozklad v stabilnejších výrobkoch; proces, že v mnohých prípadoch je výbušný. Keď cl2Ani5 Zlomí slobodu2 I2. Sa predpokladá, že vo vode, v závislosti od izoméru CL2Ani5, Je možné vytvoriť niekoľko chlórových oxoacidí.
[TOC]
Vlastnosti
Molárna hmotnosť CL2Ani5 je 150 9030 g/mol. Z tejto hmoty a jej hypotetickej molekuly možno predpokladať, že ak by sa dalo izolovať, pravdepodobne by to bola mastná kvapalina; Samozrejme, v porovnaní s fyzickým vzhľadom CL2Ani7.
Aj keď ho nemožno izolovať alebo charakterizovať, tento oxid chlóru je kyslý, kovalentný a musí mať aj malý dipólový moment. Jeho kyslosť je pochopiteľná, ak sa analyzuje chemická rovnica jej hydrolýzy:
Môže vám slúžiť: Amagat zákon: Vysvetlenie, príklady, cvičeniaCl2Ani5 + H2Alebo 2hclo3
Byť HCLO3 Kyselina chlorovod. Reverzná reakcia by viedla k prípadu, že kyselina môže byť dehydratovaná:
2HCLO3 => Cl2Ani5 + H2Ani
Na druhej strane, keď cl2Ani5 Hneď ako sa vyskytne, rozkladá sa:
2cl2Ani5 => 4clo2 + Ani2
Je to preto sprostredkovateľský druh namiesto oxidu správneho povedané. Jeho rozklad musí byť taký rýchly (vzhľadom na to, že CL je dokonca vytvorený2Ani5), ktoré nebolo možné zistiť súčasnými technikami inštrumentálnej analýzy.
Štruktúra oxidu chlóru (V)
Molekula
Na hornom obrázku bola zobrazená štruktúra hypotetickej molekuly CL2Ani5 S sférou a tyčovým modelom. Červené gule predstavujú atómy kyslíka a zelené až chlór. Každý chlór má trigonálne pyramídové prostredie, takže jeho hybridizácia musí byť SP3.
Teda molekula CL2Ani5 Môže byť vnímaný ako dve trigonálne pyramídy spojené kyslíkom. Ale ak je starostlivo pozorovaný, pyramída vedie svoje atómy kyslíka dole a druhá z roviny (v smere k čitateľovi).
Odtiaľ sa predpokladá, že v odkaze sú rotácie alebo2Cl-o-cl2, robí molekulu relatívne dynamickou. Všimnite si, že vzorec alebo2Cloclo2 Je to spôsob, ako reprezentovať štruktúru CL2Ani5.
Lewisova štruktúra
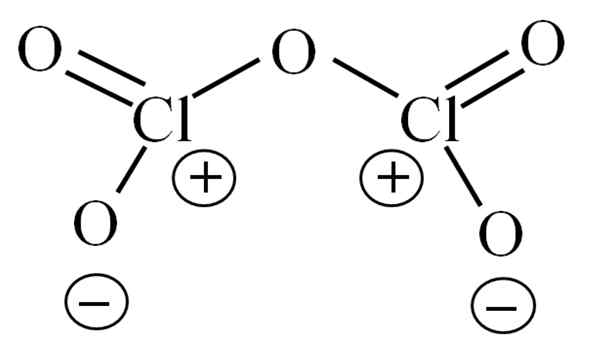 Lewisova štruktúra pre hypotetický CL2O5. Zdroj: Gabriel Bolívar.
Lewisova štruktúra pre hypotetický CL2O5. Zdroj: Gabriel Bolívar. Doteraz samotná molekula nepovolila dešifrovanie toho, čo je splatná jej nestabilita. Aby sa na túto otázku objasnila, používa sa jej Lewisova štruktúra, znázornená vyššie. Všimnite si, že je možné nesprávne myslieť, že štruktúra je plochá, ale v prednej časti sa objasnilo, že to tak nie je.
Môže vám slúžiť: azid sodný (NAN3): Štruktúra, vlastnosti, použitia, rizikáPrečo majú oba atómy chlóru pozitívne formálne zaťaženie? Pretože chlór má pár bez elektrónov, ktorý je možné overiť pri použití teórie Link Valencia (čo sa tu nezjednodušuje). Jeho formálne zaťaženie je teda:
CF = 7 - (4 + 2) = 1
A čo to má spoločné s vašou nestabilitou? Chlór je značne elektronegatívny, a preto zlý nositeľ pozitívnych formálnych zaťažení. Toto sa vracia k CL2Ani5 Mimoriadne kyslý druh, pretože potrebuje získať elektróny, aby dodal elektronický dopyt po dvoch chloros.
Opak sa stáva s BR2Ani5 a ja2Ani5, oxidy, ktoré existujú za normálnych podmienok. Je to preto, že bróm aj jód sú menej elektronegatívne ako chlór; A preto lepšie podporujú pozitívne formálne zaťaženie.
Izoméry a ich príslušná hydrolýza
Zatiaľ celé vysvetlenie kleslo na jeden z dvoch izomérov CL2Ani5: O2Cloclo2. Čo je druhý? O3Cloclo. V tomto izoméri Chloros nemá pozitívne formálne zaťaženie, a preto by mala byť stabilnejšia molekula. Avšak obidve alebo2Cloclo2 ako O3Cloclo by malo trpieť hydrolytickými reakciami:
Ani2Cl-o-cl2 + H2O => 22Cl-oh (čo nie je nič viac ako HCLO3)
Ani3CL-O-CLO + H2O => o3Cl-oh (hclo4) + HO-CLO (HCLO2)
Všimnite si, že je možné vytvoriť až tri oxoacidy chlóru: HCLO3, HCLO4 A HCLO2
Menovanie
Jeho názov „Oxid chlóru (V)“ zodpovedá prideleným podľa nomenklatúry zásob. Cl2Ani5 Môže mať tiež ďalšie dve mená: Dicloro a klarovací anhydrid pentaoxid, pridelený systematickými a tradičnými nomenklatúrami.
Môže vám slúžiť: titán: História, štruktúra, vlastnosti, reakcie, použitieŽiadosti
Viac ako motivovať počítačové štúdie, CL2Ani5 Bude chýbať, kým nebude objavený, izolovaný, charakterizovaný, uložený a ukázal, že nevybuchne do najmenšieho kontaktu.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Sandra Luján Quiroga a Luis José Perissinotti. (2011). Chlór oxoacidy a štruktúra oxidov dichlóru. Chem. Pedagóg, zv. 16.
- Chemická formulácia. (2019). Oxid chlóru (V). Získané z: Quimica Formulation.com
- Linus Pauling. (1988). Všeobecná chémia. Dover Publications, Inc., New York.
- Richard C. Štrbina. (2013). Encyklopédia alkalických zlúčenín Zeme. Elsevier.

