Štruktúra, vlastnosti, použitia hydroxidu železa
- 4951
- 1066
- Adrián Fajnor
On Železo Hydroxid (II), Tiež sa nazýva hydroxid železitý, je to anorganická zlúčenina chemickej receptúry viery (OH)2. Ak je jeho čistota vysoká, jeho pevná látka sa skladá iba z viery iónov2+ a oh- Vo vzťahu 2: 1; Molekuly vody a rôzne iónové druhy však môžu obsahovať, čím sa menia polohu.
Predstavuje „redukovanú“ formu slávnej hrdze, červenkastým povrchom zloženým z viery iónov3+; Zatiaľ čo v zelenkavej hrdze prevláda viera2+, vedľa OH- a ďalšie množstvo aniónov: co32-, SW42-, Nie3- a Haluros (f-, Cl-,… ), Napríklad. Výsledkom, hoci základňou tejto zelenej hrdze je viera (oh)2, je, že sa získavajú rôzne pevné látky.
 Zelený oxid na povrchu železa: zdrojový materiál tohto typu hydroxidu. Zdroj: Pixabay.
Zelený oxid na povrchu železa: zdrojový materiál tohto typu hydroxidu. Zdroj: Pixabay. V každodennom živote je možné tento hydroxid uvažovať na bežných miestach. Napríklad loď horného obrazu má svoj zakrytý povrch zelenej hrdze (nie patina). Existuje viera (oh)2, ale sprevádzané mnohými iónmi z morských vĺn.
Chemicky, vlastnosti a použitie tohto materiálu závisia od katiónu viery2+ a jeho tendencie oxidovať sa k transformácii na vieru3+. Je to redukčné činidlo, ktoré v základných podmienkach rýchlo reaguje s kyslíkom. Preto by sa mal používať v inertnej atmosfére a kyslých roztokoch.
[TOC]
Štruktúra hydroxidu železa (II)
Odkazy
Berúc do úvahy iba vieru (oh)2 Čisté, nie je nič viac viery iónov2+ a oh-.
Interakcie medzi nimi musia byť teoreticky iónovou povahou; Každá viera viery2+ priťahuje dva anióny oh-, ktorých neosmerové atrakcie nakoniec vytvoria štrukturálny a opakujúci sa poradie, ktoré definuje kryštál; To zase vedie k prachu zelenej hrdze.
Môže vám slúžiť: zinkový hydroxid (Zn (OH) 2)Problém je v tom, že medzi oboma iónmi existuje určitý kovalentný charakter, a preto nemožno iónového Fe-oh odkazu ignorovať. Vzhľadom na čiastočne iónový odkaz Fe-OH je možné pochopiť, že sú zoskupené do akej druhu polymérnej vrstvy.
Dvojité vrstvy hydroxidu
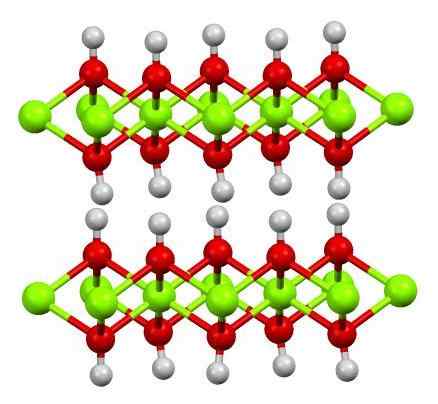
 Štruktúra viery (OH) 2. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Štruktúra viery (OH) 2. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Štruktúra čistého hydroxidu železného s modelom guľôčok a tyčí je uvedená vyššie. Fe katióny2+ Sú zastúpené chillónskou zelenou guľou, zatiaľ čo oh anióny- Pre červené a biele gule. Všimnite si, ako sú ióny viery zarovnané2+ Vďaka interakciám (iónový kovalent) s OH-.
Prečo sú táto štruktúra dvojité vrstvy hydroxidov? Samotný obrázok ponúka odpoveď: Existujú dva riadky alebo vrstvy OH- Za každú vieru2+; to znamená, že podiel 2: 1 viery (OH) je udržiavaný2 spomenuté na začiatku.
Štrukturálne jednotky pre vieru (OH)2 Sú to potom tieto sendviče, kde vrstvy OH- Prišli by zastupovať bochníky; Negatívne naložený chlieb, a preto sa nedokáže opraviť nápadný hnedý kryštál.
Ale na druhej strane, atómy H sú tiež zarovnané a zatmenia sa navzájom. Pripomínajúc koncept polarity a elektronegativity, tieto vodíny majú mierne pozitívne čiastočné zaťaženie, A+; ktoré, hoci sú slabé, môžu mať pozitívnu oblasť, v ktorej sú umiestnené iné anióny alebo molekuly.
Hydráty
Keď viera (oh)2 Rozpúšťa sa vo vode, jeho molekuly sú koordinované s kovovým centrom viery2+ Vytvorenie komplexného ACU: [viera (h2Buď)4(Oh)2]. Tento komplex má oktaedrálnu geometriu pre šesť ligandov: štyri molekuly vody a dva oh-. Avšak v hydroxidu železitého je panoráma trochu iná.
Môže vám slúžiť: Zákon o zachovaní hmotyV hydráte, hypotetický vzorec Fe (OH)2· NH2Alebo sú molekuly vody umiestnené presne medzi dvoma vrstvami hydroxidu; to znamená, že interagujú prostredníctvom dipólových iónových síl s bielymi hydrogénmi alebo guľami. Je to, akoby boli chytené dva zápasy Ohfeoh a voda bola rozptýlená, aby ich zoskupila: ohfeoh (h2O) ohfeah.
Molekuly vody sú veľmi dynamické, bránia tomu, aby hydrátové častice získali značné veľkosti, a preto tvoria solídny koloidný alebo želé.
Zelená a červená hrdza
V hydrátoch majú hydroxidové vrstvy rozptýlené molekuly vody; Môžu však mať ďalšie anióny (už spomínané), čo spôsobuje širokú škálu zelených herrkov. Môžu tiež „chytiť“ molekuly také veľké ako DNA alebo lieky.
Nielenže môžu byť prítomné ióny viery2+, Ale tiež viera3+, produkt vnútornej oxidácie spôsobený rozptýleným kyslíkom. Viditeľne by sa zistilo, že zelená hrdza (oxid u) sa začína byť červenkastá, keď sa zvyšuje koncentrácia viery3+.
Vlastnosti
 Skúmavka s železitým hydroxidom vo vode. Zdroj: Chemical Intert [Public Domain]
Skúmavka s železitým hydroxidom vo vode. Zdroj: Chemical Intert [Public Domain] Viera (OH) je uvedená vyššie2 Zráža sa v skúmavke. Komplexný ACU musí byť v hojnej vode, musí prevládať nad novo uvedenou štruktúrou. Všimnite si, že povrch vyzerá ako oranžová farba v dôsledku oxidácie viery2+ k viere3+ pre kyslík vzduchu; To znamená, že tento hydroxid je redukčným činidlom:
Vernosť2+ Vernosť3+ + a-
Fyzický vzhľad tejto zlúčeniny v jej najčistejšom stave je hnedá tuhá látka:
 Čistý hydroxid železnice. Zdroj: Ondřej Mangl [verejná doména]
Čistý hydroxid železnice. Zdroj: Ondřej Mangl [verejná doména] Čo môže byť v závislosti od úrovne vlhkosti prezentované ako želé zeleniny solídne. Je celkom nerozpustný vo vode (kspona= 8,10-16 a rozpustnosť = 0,72 g/100 ml pri 25 ° C) a má molárnu hmotnosť 89,86 g/mol a hustotu 3,4 g/ml.
Môže vám slúžiť: 20 typov chémie a ich znehodnotenieNezohlási sa žiadny bod varu alebo fúzie pre túto zlúčeninu; Pravdepodobne kvôli skutočnosti, že pred zdrojom tepla sa stane dehydratovanou a konvertuje na oxid železitý, škaredý:
Viera (oh)2 => Škaredý + h2Ani
Žiadosti
Organická kvalitatívna analýza
Jeho redukčný výkon sa používa na stanovenie prítomnosti nitro zlúčenín, RNO2. Reakcia, pre ktorú sa dosiahne pozitívny test, je reprezentovaná s nasledujúcou chemickou rovnicou:
Rno2 + 6FE (oh)2 + 4H2O => rnh2 + 6FE (oh)3
Viera (oh)3 Zráža sa ako hnedá -redizo Solid, ktorá certifikuje prítomnosť skupiny Nitro, -No2.
Redukcia oxoanónov selénu
Redukčná sila viery (OH)2 Používa tiež na zníženie aniónov SEO32- (Selenito) a SEO42- (selenate) do elementárneho selénu,. Prakticky umožňuje odstránenie takýchto aniónov, škodlivé pre zdravie, vo forme nerozpustného a ľahko odnímateľného tuhého selénu.
Dvojité vrstvy materiály
Jeho čistá štruktúra a zelená hrdza je zdrojom inšpirácie pre návrh nových materiálov mineralogických charakteristík.
Odhaduje sa, že ich funkcia umožňuje transport špecifického druhu medzi jeho vrstvami takým spôsobom, že jeho oslobodenie sa dá kontrolovať alebo redukovať na aktívne miesto (pôdy, bunky, kovový povrch atď.).
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Železo (ii) hydroxid. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). Hydroxid železnice. Databáza pubchem. CID = 10129897. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Nick Doe. (s.F.). Testy pre fenoly a nitro skupiny. Chémia 211. Zdroj: akademici.Wellesley.Edu
- Clark Jim. (27. apríla 2019). Chémia železa. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Technický softvér Kingston. (2019). Chémia hrdze. Lekári. Získané z: koróznych dusičov.orgán
- Zingaro, Ralph a. a kol. (1997). Redukcia oxoselánových aniónov hydroxidom železa (II). Medzinárodné prostredie. 23 (3): 299-304. Doi: 10.1016/S0160-4120 (97) 00032-9
- « Vlastnosti, štruktúra, použitia oxidu chlóru (V)
- Vlastnosti oxidu chlóru (III), štruktúra, použitie »

