Štruktúra oxidu zinočnatého (ZnO), vlastnosti, použitia, riziká
- 3814
- 806
- MUDr. Žigmund Boška
On oxid zinočnatý Je to anorganická zlúčenina, ktorej chemický vzorec je ZnO. Pozostáva iba z iónov Zn2+ I2- v pomere 1: 1; Jeho kryštalická sieť však môže predstavovať neobsadené miesto alebo2-, čo dáva miesto štrukturálnych defektov schopných zmeniť farby svojich syntetických kryštálov.
Komerčne sa získa ako prašná biela pevná látka (nižší obrázok), ktorá sa vyskytuje priamo z oxidácie kovového zinku francúzskym procesom; alebo podlieha karbothermickej redukcii zinkovej rudi, takže ich výpary potom oxidujú a ukončia tuvanie.
 Hodinové sklo s oxidom zinočnatého. Zdroj: Adam Rędikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Hodinové sklo s oxidom zinočnatého. Zdroj: Adam Rędikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Ďalšie metódy prípravy ZnO pozostávajú z vyrážania ich hydroxidu, Zn (OH)2, Z vodných roztokov zinkových soli. Jemné filmy alebo morfologicky rozmanité nanočastice môžu byť tiež syntetizované sofistikovanejšími technikami, ako je chemická depozícia ich výparov.
Tento kovový oxid sa nachádza v prírode ako minerál zinte, ktorého kryštály sú zvyčajne žlté alebo oranžové kvôli nečistotám kovu. Kryštály ZnO sa vyznačujú tým, že sú piezoelektrické, termochromatické, luminiscenčné, polárne a tiež majú veľmi široký energetický pás vo svojich polovodičových vlastnostiach.
Štrukturálne je izomorfný pre zinkový sulfid, Zns, prijíma hexagonálne a kubické kryštály podobné kryštálom Wurzita a Blenda. V nich je v interakciách medzi Zn určitý kovalentný charakter2+ I2-, čo vytvára heterogénne rozdelenie záťaže v kryštáli ZnO.
Štúdie vlastností a použitia ZnO sa rozširujú na oblasti fyziky, elektroniky a biomedicíny. Jeho najjednoduchšie a najviac každodenné využitie zostane bez povšimnutia zloženia krémov na tvár a osobných hygienických výrobkov, ako aj v opaľovacích krhoch.
[TOC]
Štruktúra
Polymorfy
ZnO kryštalizuje v normálnych podmienkach tlaku a teploty v hexagonálnej štruktúre Wurzite. V tejto štruktúre ióny Zn2+ I2- Sú usporiadané do alternatívnych vrstiev, takže každý z nich skončí obklopený tetraedronom, ktorý má ZnO4 alebo ozn4, respektíve.
Pomocou „šablóny“ alebo kubickej podpory môže byť ZnO kryštalizovaná v kubickej štruktúre zinkovej zmesi; čo, rovnako ako Wurzita, zodpovedá izomorfným štruktúram (identickým v priestore, ale s rôznymi iónmi) sulfidu zinočnatého, Zns.
Okrem týchto dvoch štruktúr (Wurzita a Blenda), ZnO pod vysokými tlakmi (okolo 10 GPA) kryštalizuje v štruktúre Sal Gema, rovnako ako v prípade NaCl.
Môže vám slúžiť: Referenčná elektróda: Charakteristiky, funkcie, príkladyInterakcie
Interakcie medzi Zn2+ I2- Predstavujú určitý charakter kovalencie, takže čiastočne existuje kovalentná väzba Zn-O (obe atómy s hybridizáciou SP3) a kvôli skresleniu tetraedry prejavujú dipólový moment, ktorý zvyšuje iónové atrakcie kryštálov ZnO.
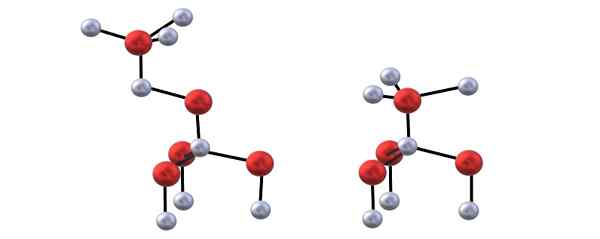
 Štruktúra Blenda (vľavo) a Wurzita (vpravo) ZnO. Zdroj: Gabriel Bolívar.
Štruktúra Blenda (vľavo) a Wurzita (vpravo) ZnO. Zdroj: Gabriel Bolívar. Máte horný obrázok na vizualizáciu vyššie uvedenej tetraedry pre štruktúry ZnO.
Rozdiel medzi štruktúrami Blenda a Wurzita tiež spočíva v tom, čo vidíte zhora, ióny sa nenachádzajú zatienené. Napríklad vo Wurzite je zrejmé, že biele gule (Zn2+) sú tesne nad červenými guľami (alebo2-). Na druhej strane, v kubickej štruktúre Blendy sa nestane, pretože existujú tri vrstvy: A, B a C namiesto iba dvoch.
Morfológia nanočastíc
Kryštály Zno Aj keď majú tendenciu mať šesťhranné štruktúry Wurzite, pokiaľ ide o morfológiu ich nanočastíc, je ďalším príbehom. V závislosti od parametrov a metód syntézy môžu okrem iného prijať formy, ktoré sú rozmanité ako tyče, dosky, listy, gule, kvety, pásy, ihly,.
Vlastnosti
Fyzický vzhľad
Pevná biela, toaleta a horká chuť. V prírode môže byť kryštalizovaný s nečistotami kovov ako minerál zincita. Ak sú také kryštály biele, majú termochromizmus, čo znamená, že keď menia sfarbenie: z bielej na žltú farbu.
Podobne ich syntetické kryštály môžu v závislosti od ich stechiometrického zloženia kyslíka v závislosti od ich stechiometrického zloženia kyslíka; to znamená, diery alebo voľné pracovné miesta spôsobené nedostatkom aniónov alebo2- priamo ovplyvňuje cestu v tom, ako svetlo interaguje s iónovými sieťami.
Molárna hmota
81 406 g/mol
Bod topenia
1974 ° C. Pri tejto teplote trpí tepelný rozklad uvoľňovaním zinku a molekulárneho kyslíka alebo plynného kyslíka.
Hustota
5,1 g/cm3
Rozpustnosť
ZnO je prakticky nerozpustný vo vode, sotva vedie k roztokom s koncentráciou 0,0004% až 18 ° C.
Anfoterizmus
ZnO môže reagovať tak s kyselinami a základňami. Keď reaguje s kyselinou vo vodnom roztoku, jeho rozpustnosť sa zvyšuje, keď sa vytvorí rozpustná soľ, kde Zn2+ končí komplexing s molekulami vody: [Zn (OH2)6]2+. Napríklad reaguje s kyselinou sírovou a vyrába sulfát zinočnatého:
ZnO + H2SW4 → Znso4 + H2Ani
Podobne reaguje s mastnými kyselinami pre formy ich príslušné soli, ako sú stearát a palmitát zinku.
Môže vám slúžiť: nezvratná reakcia: Charakteristiky a príkladyA keď reaguje so základňou, v prítomnosti vody sa tvoria sekáčikové soli:
ZnO + 2naoh + h2O → na2[Zn (OH)4]
Tepelná kapacita
40,3 j/k · mol
Priama medzera
3,3 eV. Táto hodnota je vyrobená širokopásmovým polovodičom, ktorý je schopný prevádzkovať pod intenzívnymi elektrickými poliami. Predstavuje tiež charakteristiky toho, že je typom polovodiča n, ktorý nebol schopný vysvetliť dôvody, prečo v jej štruktúre existujú ďalšie prínos elektrónov.
Tento oxid sa vyznačuje svojimi optickými, akustickými a elektronickými vlastnosťami, vďaka ktorým sa považuje za kandidáta na potenciálne aplikácie súvisiace s vývojom optoelektronických zariadení (senzory, lasery, fotovoltaické bunky). Dôvod pre takéto vlastnosti unikne z oblasti fyziky.
Žiadosti
Liečivý
Päť oxidov sa používa ako prísadka v početných bielych krémoch na liečbu podráždenia, acnes, dermatitídy, odorenia a prasklín v koži. V tejto oblasti je jeho použitie na zmiernenie podráždení spôsobených plienkami u detí populárnych.
Je to tiež súčasť opaľovacích krémov, pretože spolu s nanočasticami oxidu titaničitého2, Pomôžte blokovať ultrafialové žiarenie slnka. Podobne pôsobí ako hrubší agent, takže je to v určitom jasnom make -upu, pleťových vodách, smaltkách, mastných dužinách a mydlách.
Na druhej strane, ZnO je pätnásť zdroj, ktorý sa používa v výživových doplnkoch a vitamínových výrobkoch, ako aj v cereáliách.
Antibakteriálny
Podľa morfológie jej nanočastíc sa ZnO môže aktivovať pri ultrafialovom žiarení, aby sa vytvorilo peroxidy vodíka alebo reaktívne druhy, ktoré oslabujú bunkové membrány mikroorganizmov.
Keď sa to stane, zostávajúce nanočastice ZnO prechádzajú cytoplazmou a začnú interagovať s kompendiom biomolekulov, ktoré tvoria bunku, čo v dôsledku.
To je dôvod, prečo nie všetky nanočastice sa dajú použiť v kompozíciách slnečných krémov, ale iba tie, ktoré nemajú antibakteriálnu aktivitu.
Výrobky s týmto typom ZnO sa prideľujú, pokryté rozpustnými polymérnymi materiálmi, na liečbu infekcií, rany, vredov, baktérií a dokonca aj cukrovky.
Pigmenty a povlaky
Pigment známy ako Cinco Blanco je ZnO, ktorý sa pridáva k niekoľkým obrazom a povlakom na ochranu kovových povrchov pred koróziou, kde sú aplikované. Napríklad závislé povlaky ZnO sa používajú na ochranu pozinkovaného železa.
Na druhej strane sa tieto povlaky používali aj na pohári okien, aby sa zabránilo preniknutiu tepla (ak je v zahraničí) alebo vstúpte (ak je vo vnútri). Chráni tiež niektoré polymérne a textilné materiály pred jeho zhoršením pôsobením slnečného žiarenia a tepla.
Môže vám slúžiť: draslík (k)Biologický obraz
Študovala sa luminiscencia nanočastíc ZnO, aby sa použila pri bioimagingu, a tak študovala cez modré, zelené alebo oranžové svetlá, ktoré vyžarujú, vnútorné štruktúry buniek.
Prídavný
ZnO tiež nachádza použitie ako prísada v gumách, cementoch, dentifrických materiáloch, skle a keramike, kvôli jeho nižšiemu bodu topenia, a preto sa správajú ako zakladajúce činidlo.
Eliminátor sulfidu vodíka
ZnO eliminuje nepríjemné plyny H2S, pomáha pri zasadnutí niektorých emanácií plynu:
ZnO + H2S → Zns + h2Ani
Riziká
Finch Oxid ako taký je nettoxická a neškodná zlúčenina, takže obozretná manipulácia s jej tuhou látkou nepredstavuje žiadne riziko.
Problém však spočíva v jeho dyme, pretože hoci pri vysokých teplotách sa rozkladá, Rav výpary končia kontaminujúce pľúca a spôsobujú určitý druh „kovovej horúčky“. Toto ochorenie sa vyznačuje príznakmi kašľa, horúčkou, pocitom útlaku v hrudi a konštantnou kovovou chuťou v ústach.
Ani rakovina nie je a krémy, ktoré ho obsahujú, nepreukázali, že zvyšujú absorpciu zinku v koži, takže slnko založené na ZnO sa považujú za bezpečné; Pokiaľ neexistujú alergické reakcie, ktoré v takom prípade musia zastaviť jeho použitie.
Pokiaľ ide o určité nanočastice určené na boj proti baktériám, mohli by mať negatívne účinky, ak nie sú správne prepravené na svoje pôsobenie.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Oxid zinočnatý. Zdroj: In.Wikipedia.orgán
- Hadis Morkoç a ümit Özgur. (2009). Oxid zinku: základná, materiálová a technológia zariadení. [PDF]. Obnovené z: Aplikácie.Wiley-vch.z
- Parihar, m. Raja a R. Pauza. (2018). Stručný prehľad štrukturálnych, elektrických a elektrochemických vlastností nanočastíc oxidu zinočnatého. [PDF]. Obnovené z: IPME.Ruka
- Do. Rodnyi a ja. Vložka. Khodyuk. (2011). Optické a luminiscenčné vlastnosti oxidu zinočnatého. Získané z: arxiv.orgán
- Siddiqi, K. Siež., Ur Rahman,., Tajuddin a Husen, a. (2018). Vlastnosti nanapartice oxidu zinočnatého a aktivity ES proti mikróbom. Nanoscale Research Letters, 13 (1), 141. Doi: 10.1186/s11671-018-2532-3
- Chemické paletyfakty. (2019). Oxid zinočnatý. Získané z: ChemicalSaFetyFacts.orgán
- Jinhuan Jiang, Jiang Pi a Jiye Cai. (2018). Postup nanočastíc oxidu zinočnatého pre biomedicínske aplikácie. Bioinorganická chémia a aplikácie, zv. 2018, ID článku 1062562, 18 strán. doi.org/10.1155/2018/1062562
- « Štruktúra peroxidu vodíka (H2O2), vlastnosti, použitie, získanie
- Štruktúra síranu sodného (Na2SO4), vlastnosti, použitie, získanie »

