Štruktúra síranu sodného (Na2SO4), vlastnosti, použitie, získanie

- 4439
- 708
- MUDr. Žigmund Boška
On síran sodný Je to anorganická soľ, ktorej chemický vzorec je NA2SW4. Skladá sa z bielej pevnej látky, ktorá je prítomná v troch formách: bezvodý, heptohydrát (málo existencie) a decayropera (ktorý je známy ako Glaubert soľ); Ten je najhojnejšou formou síranu sodného.
Rozpadaný sodný sodný, NA2SW4· 10h2Alebo ho objavil v roku 1625 Glaubert vo vode jari, ktorý ho vymenoval Saltabilis (zázračná soľ) kvôli svojim liečivým vlastnostiam.
 Hodinové sklo so vzorkou síranu sodného. Zdroj: Walkerma cez Wikipedia.
Hodinové sklo so vzorkou síranu sodného. Zdroj: Walkerma cez Wikipedia. Sulfát sodný má početné aplikácie v textilnom a papierovom priemysle, ako aj vo výrobe skla. Jeho použitia sa rozširujú s tepelnými aplikáciami, ktoré zahŕňajú environmentálne dodávky tepla a chladenie notebookov.
Sulfát sodný je zlúčenina nízkej toxicity a jeho škodlivých akcií, sú v zásade mechanické a ne -chemické. Z kryštalografických dôvodov táto soľ, podobne ako jej náprotivok poerase, K2SW4, predstavuje rámec a polymorfné štruktúry.
[TOC]
Štruktúra
Bezvodná soľ
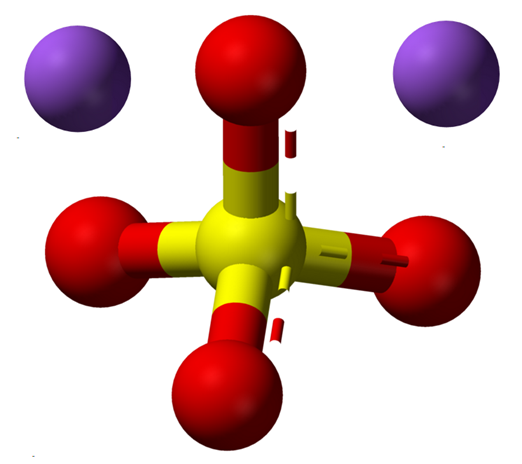 Ióny sodného sodného. Zdroj: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Ióny sodného sodného. Zdroj: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Vzorec2SW4 Indikuje ióny NA v kryštáloch soli+ A tak42- Sú vo vzťahu 1: 2; to znamená pre každé dve katióny na+ je tu anión42- Interakcia s nimi elektrostatickou príťažlivosťou (vynikajúci obraz).
Samozrejme to platí pre NA2SW4 bezvodý, bez molekúl vody koordinovaných s sodíkom vo vnútri kryštálov.
 Síran sodný
Síran sodný Napriek tomu, že je to jednoduchý vzhľad, jeho opis je štrukturálne zložitý. Potom2SW4 Predstavuje polymorfizmus, ktorý má až päť kryštalických fáz: I, II, III, IV a V, ktorého prechodné teploty sú 180, 200, 228, 235 a 883 ° C, resp.
Aj keď neexistujú žiadne odkazy, ktoré by ho potvrdili, NA2SW4I Musí to byť tá, ktorá má šesťuholníkovú kryštalickú štruktúru, v porovnaní s na ortombický2SW4Iii, v ktorom kryštáli Na+ Tetrahedra forma (nao4) a oktaedros (nao6) koordinácia; to znamená, že môže byť obklopený štyrmi alebo šiestimi aniónmi42-.
Slaná soľ
Medzitým monoklinická kryštalická štruktúra jej najdôležitejšieho hydrátu, na2SW4· 10h2Alebo je to jednoduchšie. V ňom sú to prakticky molekuly vody, ktoré interagujú alebo koordinujú s Na+ V oktafedre na (h2Buď)6+, S SO42- Sotva prispel dostatočnou stabilitou k sklu, aby existovala v pevnej fáze.
Môže vám slúžiť: prvá chemická revolúciaJeho bod topenia (32,38 ° C) však omnoho nižší ako v prípade bezvodej soli (884 ° C) ukazuje, ako molekuly vody a ich vodíkové mostíky oslabujú iónové interakcie, silnejšie, v NA2SW4.
Vlastnosti
Mená
-Sulfát sodný (IUPAC)
-Glauber Salt (dehydrát)
-Sala Miracoulous (Decayroper)
-Sírany disodia.
Molárna hmota
142,04 g/mol (anh ¡dro)
322,20 g/mol (decydrát)
Fyzický vzhľad
Biely hygroskopický kryštalický tuhá látka
Vôňa
Záchod
Príchuť
Horký a fyziologický roztok
Hustota
2 664 g/cm3 (bezvodý)
1 464 g/cm3 (Dahydrát)
Všimnite si, ako molekuly vody vo vnútri kryštálov spôsobujú rozšírenie, a preto znižujú ich hustotu.
Bod topenia
884 ° C (bezvodý)
32,38 ° C (dehydrát)
Bod varu
1.429 ° C (bezvodý)
Rozpustnosť
4,76 g/100 ml (0 ° C)
13,9 g/100 ml (20 ° C)
42,7 g/100 ml (100 ° C)
Všetky hodnoty rozpustnosti zodpovedajú bezdôvodnej soli, ktorá je vo všetkých teplotách celkom rozpustná vo vode.
Rozpustnosť sa náhle zvyšuje medzi 0 ° C a 38,34 ° C, pričom pozoruje, že v tomto rozsahu rozpustnosti teplôt sa zvyšuje viac ako 10 -krát viac ako 10 -krát. Od 32,38 ° C je však nezávislá od teploty.
Stáva sa, že pri teplote 32,8 ° C sa decayedrate síran sodný rozpustí vo svojej vlastnej kryštalickej vode. Preto rovnováha medzi decayydrátovou soľou, anhydrou soľou a nasýteným roztokom síranu sodného.
Pokiaľ sa zachová podmienka troch fáz, teplota zostane konštantná, čo umožňuje kalibráciu teploty teplomerov.
Na druhej strane, rozpustnosti pre heptahydrátovú soľ sú:
19,5 g/100 ml (0 ° C)
44,0 g/100 ml (20 ° C)
Všimnite si, že pri 20 ° C je heptahydrátová soľ trikrát rozpustnejšia ako bezvodý.
Index lomu
1 468 (bezvodý)
1 394 (dechydrát)
Stabilita
Stabilné za odporúčaných podmienok skladovania. Nezlučiteľné so silnými kyselinami a základňami, hliník a horčík.
Rozklad
Keď sa zahrieva na rozklad, emituje toxický dym oxidu síry a oxidu sodného.
pH
5 % vodný roztok má pH 7.
Reaktivita
Sulfát sodný sa disociuje vo vodnom roztoku v 2 NA+ A tak42-, čo umožňuje kombináciu sulfátového iónu s BA2+ Na zrážanie síranu bárňa. Prakticky pomáha pohybovať bárňové ióny vzoriek vody.
Môže vám slúžiť: TransamináciaSulfát sodný sa stáva sulfidom sodným reakciou pri vysokých teplotách s uhlím:
Nat2SW4 + 2 c => na2S +2 co2
Glaubertova soľ, naso4.10 hod2O reaguje s uhličitanom draselným na výrobu uhličitanu sodného.
Žiadosti
Priemysel
Sulfát sodný sa používa vo výrobe papierovej buničiny. Používa sa pri vypracovaní papiera Kraft, ktorý neobsahuje lignín alebo odosielajúceho procesu bielenia, dôvod, ktorý mu dáva veľký odpor. Okrem toho sa používa v kartónovej výrobe.
Detergenty
Používa sa ako materiál na vyplnenie syntetického detergentu na použitie doma, čím sa pridáva do čistiaceho prostriedku na zníženie povrchového napätia.
Pohár
Používa sa vo výrobe skla na zníženie alebo odstránenie prítomnosti malých vzduchových bublín v roztavenom skle. Okrem toho eliminuje tvorbu trosky počas procesu rafinácie roztaveného skla.
Textilný priemysel
Sulfát sodný sa používa ako mordant, pretože uľahčuje interakciu farbív s textilnými vláknami. Detahydrovaný síran sodný sa používa pri teste farbiva.
Okrem toho sa síran sodný používa ako riedenie farbiva a pomocné tlačiarenské látky; ako sú priame farbivá, farbivá síry a ďalšie látky, ktoré uprednostňujú farbenie bavlny. Používa sa tiež ako agent, ktorý oneskoruje priame farbivá hodvábu.
Liek
Dechrid síran sodný sa používa ako preháňadlo, pretože je málo absorbovaný v čreve, a preto zostáva vo svetle, čo spôsobuje zvýšenie objemu. To stimuluje zvýšenie peristaltických kontrakcií, ktoré indukujú vylúčenie obsahu čreva.
Sulfát sodný je protijed na kontrolu otravy s báriami a olovenými soľami. Glaubertova soľ je účinná na odstránenie nadmerne požívaných niektorých liekov; Napríklad paracetamol (acetoaminofén).
Okrem toho sa používa na zásobovanie zlým elektrolytom prítomnosťou v izoosmotických roztokoch.
Sušiaci agent
Sulfát sodný, pretože je inertným činidlom, sa používa na odstránenie vody z roztokov organických zlúčenín.
Surový materiál
Sulfát sodný sa používa ako surovina na výrobu mnohých látok, vrátane: sulfidu sodného, uhličitanu sodného a síranu amónneho.
Môže vám slúžiť: plynová chromatografiaZískanie
Sulfát sodný sa získava extrakciou ťažby a chemickými reakciami.
Ťažba
Existujú tri rudy alebo minerály, ktoré sa využívajú s komerčným výkonom: potom2SW4), Mirabilita (na2SW4· 10h2O) a glaubarita (na2SW4· Prípad4).
V Španielsku sú ložiská Thearardita a Mirabilita využívané podzemnou ťažbou galérií a pilierov. Medzitým sa Glauberita získava na otvorenom priestranstve, veľkými raftami, ktoré sú umiestnené na minerálnej nádrži.
Terén sa pripravuje s otryskaním s nízkou intenzitou, aby sa vytvorila pórovitosť, ktorá umožňuje vylúhovanie síranu sodného. Výrobná fáza sa vyskytuje pri zavlažovaní postrekovača s čerstvou vodou z Glauberita, ktorej vylúhovanie sa šíri zostupným spôsobom.
Zhromažďuje sa soľanka síranu sodného, pričom sa vyplní zvyšok síranu vápenatého.
Chemická výroba
Sulfát sodný sa získava počas výroby kyseliny chlorovodíkovej prostredníctvom dvoch procesov: proces Mannheim a proces hardgrenave.
Mannheimový proces
Robí sa vo veľkých oceľových peciach a so 6 m oceľovo reakčnou plošinou. Reakcia dochádza medzi chloridom sodným a kyselinou sírovou:
2 NaCl +h2SW4 => 2 HCl +na2SW4
Proces hardreave
Zahŕňa reakciu chloridu sodného, oxidu síry, kyslíka a vody:
4 NaCl + 2 SO2 + Ani2 + 2 h2O => 4 HCl +na2SW4
Ďalší
Sulfát sodný sa vyskytuje pri neutralizačnej reakcii medzi hydroxidom sodným a kyselinou sírovou:
2 naoh +h2SW4 => Na2SW4 + H2Ani
Sulfát sodný je vedľajším produktom výroby mnohých zlúčenín. Extrahuje sa z kvapalného odpadu vypusteného počas výroby viskózy a celofánu. Aj pri výrobe dichromátu sodného, fenolov, kyseliny boritej a lítium karbamátu.
Riziká
Sulfát sodný sa považuje za zlúčeninu s nízkou toxicitou. Môže však spôsobiť určité škody osobe, ktorá ju používa nevhodná.
Napríklad môžete spôsobiť podráždenie očí, začervenanie a bolesť. V koži môže u niektorých ľudí spôsobiť podráždenie a alergiu. Jeho požitie môže spôsobiť podráždenie tráviaceho traktu s nevoľnosťou, zvracaním a hnačkou. A nakoniec, jeho vdýchnutie vyvoláva podráždenie v respiračnom trakte.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Síran sodný. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). Síran sodný. Databáza pubchem. CID = 24436. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- B. N. Mehrotra. (1978). Kryštálová štruktúra NA2SW4Iii. Obnovené z: rruff-2.geo.Arizona.Edu
- Glauberita-Thenardita (síran sodný). [PDF]. Získané z: IGME.je
- « Štruktúra oxidu zinočnatého (ZnO), vlastnosti, použitia, riziká
- Charakteristiky Lactofenolovej modrej, zloženie, príprava, použitia »

