Štruktúra peroxidu vodíka (H2O2), vlastnosti, použitie, získanie
- 2062
- 106
- Václav Višňovský
On peroxid vodíka Je to anorganická zlúčenina, ktorej chemický vzorec je H2Ani2. Každý je najjednoduchším peroxidom tejto rodiny chemických zlúčenín. Jeho štrukturálna receptúra je H-O-O-H, tento vnútorný okysličený most je charakteristický pre všetky peroxidy.
V roku 1818, h2Ani2 Identifikoval ju Louies Jacques Thénard, ktorý pripravil chemickú zlúčeninu, ktorú požadoval vtedy Huzigenada. Je to nestabilná zlúčenina, rozkladá sa vystavením svetlu, tepla a niektorým kovom.
 Chemický vzorec peroxidu vodíka
Chemický vzorec peroxidu vodíka Je to veľmi užitočná zlúčenina, ktorá sa používa pri dezinfekcii menších rán, bielenia vlasov, úpravy vody atď. Aj keď môže mať škodlivé činy pre človeka, nachádza sa vo všetkých eukaryotických bunkách živých bytostí, kde vykonáva niekoľko prospešných funkcií.
Peroxid vodíka produkuje oxidáciu toxických látok, ako sú fenoly, etanol, formaldehyd atď., výrobky, ktoré sú vylúčené pečeňou a obličkami. Okrem toho prispieva k deštrukcii baktérií fagocytovaných neutrofilovými a makrofágovými leukocytmi.
[TOC]
Štruktúra
Molekula
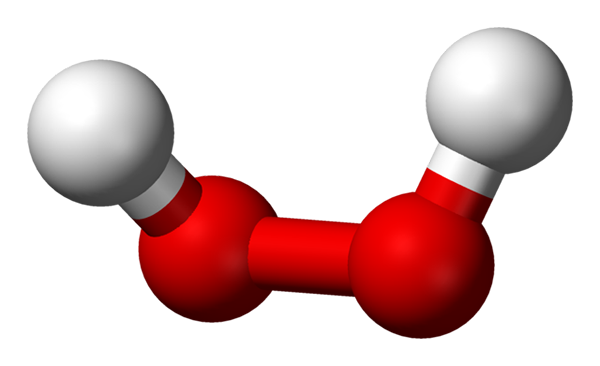 Molekula peroxidu vodíka predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Benjah-Bmm27 Via Wikipedia.
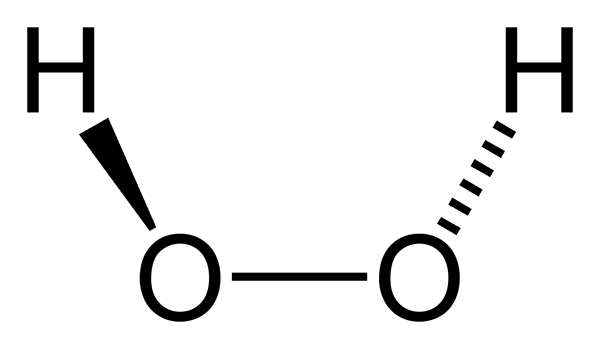
Molekula peroxidu vodíka predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Benjah-Bmm27 Via Wikipedia. Na vynikajúcom obraze je možné vidieť štruktúru molekuly H2Ani2 (H-O-O-H), s červenými guľami zodpovedajúcimi atómom kyslíka a atómami bieleho vodíka. Všimnite si, že molekula nie je plochá a že ani atómy H nie sú zatienené vo vesmíre (jeden pred druhým).
Je zaujímavé, že h2Ani2 Je ťažké otočiť jeho jednoduché centrálne spojenie O-O, takže polohy týchto h sa nedajú vymeniť; Človek nebude klesať, kým druhý stúpne.
Pretože? Pretože v dvoch atómoch kyslíka existujú dva páry bez elektrónov, ktoré poskytujú celkom osem veľmi blízkych elektrónov a ktoré sa navzájom odpudzujú za svoje záporné náboje.
Striedanie
Napriek tomu sa Link O-O pravdepodobne otočí v dôsledku interakcií s jeho okolím.
Napríklad, keď spolu s dvoma palcami, s predĺženými prstami a ostatnými sa zatvorili, napríklad kreslenie súdu a potom otočenie palcov tak, aby sa jeden z prstov zameriaval dopredu a druhý dozadu, bude tu približná reprezentácia H2Ani2.
Ak telo hrá niektorý z indexov, palec sa otočí v reakcii na túto interakciu; Okamžite sa však vrátia do svojej pôvodnej polohy kvôli vyššie uvedeným elektronickým odporom. Tieto rotácie vytvárajú dynamické aspekty tejto molekuly.
Intermolekulárne interakcie
V kvapalnom stave H2Ani2 dokáže zriadiť vodíkové mosty (HOOH-O2H2), inak by jeho vysoký bod varu (150 ° C) nebol vysvetlený v porovnaní s vodou.
Môže vám slúžiť: Síran vápenatý (Case4): Chemická štruktúra, vlastnosti, použitiaAkonáhle prechádza do plynovej fázy, m molekuly2Ani2 Pravdepodobne už nemôže takéto mosty tvoriť, nielen do najväčšej intermolekulárnej vzdialenosti, ale aj atómy vodíka by sa mali dotknúť v prípade zrážok (to sa dá vizualizovať uchýlením späť k modelu prsníkov).
Medzitým v tuhej fáze uhol lietadiel, ktoré stanovujú H 90 ° (vložte kolmé prsty) prsty). Teraz sa mosty vodíka stávajú ešte dôležitejšími a h molekuly2Ani2 Sú objednané v kryštáli tetragonálnej štruktúry.
Vlastnosti
Sbotella s peroxidom vodíka. V lekárňach sa dosahuje koncentráciou 3% m/v. Zdroj: pixnio.
Mená
-Peroxid vodíka
-Dioxidano
-Oxidanol
-Kyselina perhydoxová
-O-hydroxyol
-Peroxid vodíka
Molárna hmota
34 0147 g/mol
Fyzický vzhľad
Svetlo modrá (koncentrovaná) alebo bezfarebná. Je o niečo viskóznejší a hustejší ako voda. Je destilovaný pre bezpečnosť pri nízkych teplotách a znížení tlaku, pretože sa rozkladá výbušným zahrievaním.
Vôňa
Akútna alebo vôňa podobná ozónu.
Príchuť
Horký
Hustota
Masívne 1,71 g/cm3
Hustoty ich vodných roztokov závisia od ich koncentrácie; Napríklad 27 % má hustotu 1,10 g/cm3, zatiaľ čo 50 %, 1,13 g/cm3
Bod topenia
- 0,43 ° C
Bod varu
150,2 ° C. Táto hodnota sa získala extrapoláciou, pretože peroxid vodíka sa rozkladá pri vysokých teplotách.
Rozpustnosť
Misilné ≥ 100 mg/ml pri 25 ° C
Rozpustnosť
Je rozpustný v éter a alkoholoch, ale nerozpustný v olejovom éteru. Rozkladá sa vo vode a kyslíku v mnohých organických rozpúšťadlách.
Koeficient priečneho októbra/vody
Log p = - 0,43
Tlak vodnej pary
5 mmHg pri 30 ° C.
Disociačná konštanta
Pka = 11,72
pH
Roztoky peroxidu vodíka sú mierne kyslé. Napríklad jedna až 35% má pH 4,6; Ale pri koncentrácii na 90%sa pH stáva menej kyslý: 5,1.
Index lomu (nD)
1 4061
Hrebeň
1 245 CPoise pri 20 ° C.
Tepelná kapacita
1 267 j/g · k (plyn)
2 619 j/g · k (tekutina)
Odparovanie
1 519 j/g · k
Stabilita
Stabilný za odporúčaných podmienok. Pridanie acetanylidu a cínových solí ho viac stabilizuje.
Korózia
Korozívny
Rozklad
Rozkladá sa vystavením svetlu alebo v prítomnosti oxidačných a redukčných látok. Tiež sa rozkladá otepľovaním. Keď je zadržaný, uvoľňuje sa voda a kyslík a uprednostňujú sa zvýšením pH a teploty, ako aj s prítomnosťou enzýmu catlasu.
Môže vám slúžiť: peroxid sodný (Na2O2): štruktúra, vlastnosti, použitiaPovrchové napätie
80,4 DIN/cm A 20 ° C
Reaktivita
H2Ani2 Pôsobí ako oxidačné činidlo v kyslých roztokoch železa železa (viera2+) Železo z železa (F3+); tiež oxidujte sulfitov ión (tak32-) do sulfátového iónu (tak42-).
Môže tiež pôsobiť ako redukčné činidlo v prítomnosti základných roztokov, redukcie na chlórnan sodný (NaOCL) a permanganát draslíka (KMNO4) S uvoľňovaním kyslíka.
Žiadosti
Bielenie
Peroxid vodíka sa používa v papierovom priemysle pri bielení buničiny a papiera, ktorý spotrebuje väčšinu svojej ročnej výroby.
Dezinfekčný prostriedok
Peroxid vodíka je jemný antiseptikum, aby sa zabránilo infekcii malých rán, škrabancom a popáleninám. Používa sa tiež ako opláchnutie úst a na zmiernenie podráždenia miernych úst v dôsledku prítomnosti náustkov alebo gingivitídy.
Používa sa tiež na dezinfekciu povrchov, vnútra chladničiek, vody a boja proti nadmernému rastu baktérií vo vodných systémoch a chladiacich vežách. Peroxid vodíka uvoľňuje radikály bez kyslíka, ktoré rozkladajú znečisťujúce látky.
Detergent
Peroxid vodíka sa používa pri výrobe bieliacich detergentov oblečenia vrátane uhličitanu sodného. Táto zlúčenina je komplex uhličitanu sodného a peroxidu vodíka, ktorý sa rozpustí vo vode, ktorá sa oddeľuje vo svojich zložkách.
Kozmetická aplikácia
Zriedený peroxid vodíka sa používa pri bielení vlasov pred zafarbením. Používa sa tiež na bielenie zubov ako súčasť domáceho zubného krému.
Hnacia osoba
Peroxid vodíka sa používa ako monoporpeltantka alebo oxidačná zložka bipropoonous rakety. Rozkladá uvoľňovanie kyslíka a vody, čo je charakteristika, ktorá umožnila jeho použitie ako hnacianky.
Reakčná bunka sa čerpá s prítomnosťou katalyzátora, ktorý zrýchľuje uvedený rozklad. Počas tohto sa vodná para vyrába pri vysokej teplote.
Keď je para vylúčená medzerami, vytvorí sa impulz. Ponorka V-80 postavená v roku 1940, ktorá sa používa v kyslíkových turbínach generovaných z peroxidu vodíka; nazývaný systém turbíny Walter.
Získanie
Spočiatku sa peroxid vodíka získal priemyselne hydrolýzou persulfátu amónneho, [(NH4)2Siež2Ani8] alebo elektrolýza bisulfátu amónneho, NH4HSO4.
Peroxid vodíka sa získava priemyselne pomocou antrachinónu. Tento proces sa vykonáva v štyroch štádiách: hydrogenácia, filtrácia, oxidácia, extrakcia a čistenie.
Môže vám slúžiť: fluorid horečnatý: štruktúra, vlastnosti, syntéza, použitieHydrogentácia
Alquilantrochinona sa hydrogenuje prechádzajúcich plynným vodíkom cez hydrogenátor zaťažený hlinitou a malým množstvom katalyzátora (paladium). Teplota je udržiavaná na 45 ° C s trvalým miešaním.
Alkyndrochinón sa premieňa na alquiloantrahydroquinona a tetrahydroalquilanrahdrochinón, pričom ho vyberie pre svoje najväčšie pohodlie pre nasledujúce postupy.
Filtrácia
Riešenie obsahovalo.
Oxidácia
Filtrovaný roztok oxiduje cez ňu prechodom vzduchu a tvorí peroxid vodíka s nízkou čistotou.
Extrakcia a čistenie
Roztok s peroxidom vodíka prechádza krížom extrakčnej kolóny s kvapalinou kvapaliny. Voda preteká cez kolón, zatiaľ čo roztok s peroxidom vodíka je ním čerpaný.
Voda dosahuje spodok extraktora koncentráciou peroxidu vodíka medzi 25 a 35 % P/P. Potom sa čistí vákuovým destiláciou na 30 % koncentráciu peroxidu vodíka. Konečne stabilizované a uložené.
Riziká
 Peroxid vodíka. Zdroj: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Peroxid vodíka. Zdroj: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Peroxid vodíka je korozívne činidlo, takže kontakt s pokožkou vyvoláva okrem dočasného bielenia (vynikajúci obraz) vážne podráždenie (vynikajúci obraz). Môže tiež spôsobiť poškodenie očí, svrbenie, soľné, začervenanie a tvorbu ampulkov.
Jeho vdýchnutie vytvára podráždenie v nose, krku a pľúcach. Medzitým môže opakovaná expozícia spôsobiť bronchitídu, kašeľ, hlieb a dýchacie skrátenie. A akoby to nestačilo, generuje tiež bolesti hlavy, vahid, nevoľnosť a zvracanie.
Vážna expozícia peroxidu vodíka môže produkovať akumuláciu kvapalných v pľúca.
Správa bezpečnosti a ochrany zdravia pri práci (OSHA) stanovila maximálnu prípustnú prípustnú pre peroxid vodíka 1 ppm v pracovnom prostredí za 8 -hodinový deň. Avšak, pretože ide o mutagénnu zlúčeninu, musí sa znížiť vystavenie minimum.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Peroxid vodíka. Zdroj: In.Wikipedia.orgán
- William R. Busing a Henri a. Vyberať. (2004). Kryštálová a molekulárna štruktúra peroxidu vodíka: štúdia neutrónovej difrakcie. doi.org/10.1063/1.1696379
- Národné centrum pre biotechnologické informácie. (2019). Peroxid vodíka. Databáza pubchem. CID = 784. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Redaktori Enyclopaedia Britannica. (27. novembra 2018). Peroxid vodíka. Encyclopædia Britannica. Získané z: Britannica.com
- Ministerstvo zdravotníctva v New Jersey. (2016). Peroxid vodíka. [PDF]. Získané z: NJ.Vláda
- Mathews, C. Klimatizovať., Van Holde, K. A., Ahern, K. G. (2002). Biochémia. Tretia edícia. Pearson Addison Wesley Editorial
- MD Web. (2019). Peroxid vodíka. Zdroj: WebMD.com
- « História aztékovej medicíny, Boh, rastliny, choroby
- Štruktúra oxidu zinočnatého (ZnO), vlastnosti, použitia, riziká »

