Štruktúra oxidu siričitého (SO3), vlastnosti, riziká, použitie
- 4321
- 938
- Tomáš Klapka
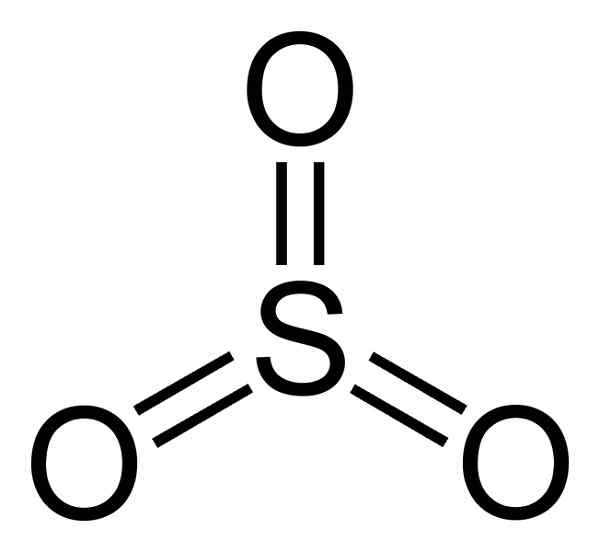
On Oxid síry Je to anorganická zlúčenina tvorená spojením atómu (S) a 3 atómami kyslíka (O) (O). Jeho molekulárny vzorec je taký3. Pri izbovej teplote, SO3 Je to tekutina, ktorá vydáva plyny vo vzduchu.
Štruktúra SO3 Plyn je plochý a symetrický. Tri kyslík sú umiestnené spravodlivo okolo síry. Tak3 Násilne reaguje vodou. Reakcia je exotermická, čo znamená, že teplo sa vytvára inými slovami, veľa sa zahrieva.
 Molekula oxidu sír3. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Molekula oxidu sír3. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Keď tak3 Kvapalné chladenie, stáva sa tuhou látkou, ktorá môže mať tri typy štruktúry: alfa, beta a gama. Najstabilnejší je alfa vo forme vrstiev spolu so sebou, ktorá predstavuje sieť.
Gaseous Trioxid siričitého sa používa na prípravu kyseliny fajčiarovej sírovej, ktorá sa tiež nazýva olej, kvôli jej podobnosti olejom alebo mastnou látkou. Ďalšia z jej dôležitých aplikácií je sulfonácia organických zlúčenín, to znamená pridanie skupín -so3- k týmto. Preto je možné pripraviť užitočné chemikálie, ako sú detergenty, farbivá, pesticídy.
Tak3 Je to veľmi nebezpečné, môže spôsobiť vážne popáleniny, oči a poškodenie kože. Nemalo by sa to ani vdýchnuť alebo požívať, pretože môže spôsobiť smrť vnútornými popáleninami, v ústach, pažeráku, žalúdku atď.
Z týchto dôvodov sa musí manipulovať s veľkou opatrnosťou. Nikdy by ste nemali kontaktovať vodu alebo horľavé materiály, ako je drevo, papier, tkaniny atď., Oheň je možné vyrobiť. Nemalo by sa zlikvidovať ani kanalizácia kvôli nebezpečenstvu výbuchu.
Tak3 Plynný generovaný v priemyselných procesoch by sa nemal uvoľňovať do životného prostredia, pretože je to jeden z tých, ktorí sú zodpovední za kyslý dažď, ktorý už poškodil veľké rozšírenia lesov na svete.
[TOC]
Štruktúra
Molekula oxidu trikxidu SO3 V plynnom stave má plochú trojuholníkovú štruktúru.
To znamená, že v rovnakej rovine sa nachádzajú síra aj tri kyslíky. Okrem toho je distribúcia kyslíka a všetkých elektrónov symetrická.
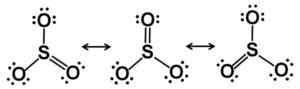 Lewis rezonančné hviezdy. Elektróny sú spravodlivo rozdelené do SO3. Autor: Marilú Stea.
Lewis rezonančné hviezdy. Elektróny sú spravodlivo rozdelené do SO3. Autor: Marilú Stea. V tuhom stave sú známe tri typy štruktúry SO3: Alfa (a-tak3), beta (p-tak3) a gama (y-tak3).
Gama forma y-tak3 Obsahuje cyklické zastrihávače, to znamená tri jednotky3 spoločne tvoriace cyklickú alebo krúžkovú molekulu.
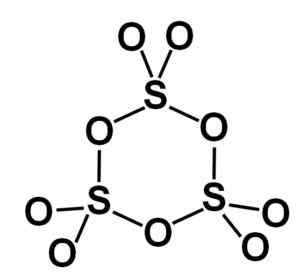 Kruhová molekula gama tuhého siričitého typu trioxidu. Autor: Marilú Stea.
Kruhová molekula gama tuhého siričitého typu trioxidu. Autor: Marilú Stea. Beta β-tak fáza3 Má nekonečné špirálové reťazce zloženia Tetrahedra4 spájajú sa.
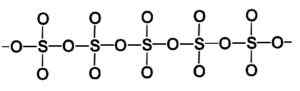 Štruktúra tuhej beta typu trioxidu siričitého. Autor: Marilú Stea.
Štruktúra tuhej beta typu trioxidu siričitého. Autor: Marilú Stea. Najstabilnejším spôsobom je alfa a-tak3, Podobne ako beta, ale so štruktúrou vrstvy, pričom Spojené reťazce tvoria sieť.
Menovanie
-Oxid síry
-Anhydrid
-Oxid sulfúru
-SW3 Gama, γ-tak3
-SW3 beta, β-so3
-SW3 Alfa, a-tak3
Fyzikálne vlastnosti
Fyzický stav
Pri teplote miestnosti (okolo 25 ° C) a atmosférickým tlakom, SO3 Je to bezfarebná tekutina, ktorá vyžaruje výpary vo vzduchu.
Keď tak3 Kvapalina je čistá pri 25 ° C, je zmes SO3 monomérna (jediná molekula) a trimérne (3 viazané molekuly) vzorca S3Ani9, Tiež sa volalo tak3 Gama y-tak3.
Môže vám slúžiť: Rankine Scale: Čo je, konverzie, príkladyPri znižovaní teploty, ak je to tak3 Je čistá, keď dosiahne 16,86 ° C, stuhne alebo zamrzne y-tak3, Tiež sa nazýva „Takže ľad3„.
Ak obsahuje malé množstvo vlhkosti (dokonca aj extrémne malé stopy alebo množstvá)3 Polymerizuje beta β-tak3 ktorý tvorí kryštály s hodvábnym jasom.
Potom sa vytvorí viac odborov generovaním štruktúry a-SO3, čo je kryštalická tuhá látka vo forme ihiel, ktoré pripomínajú azbest alebo azbest.
Keď alfa a beta tavenina generujú gama.
Molekulová hmotnosť
80,07 g/mol
Bod topenia
SW3 Gama = 16,86 ° C
Trojitý bod
Je to teplota, pri ktorej sú prítomné tri fyzikálne stavy: pevná, kvapalná a plynná. Vo forme alfa je trojitý bod na 62,2 ° C a v beta je 32,5 ° C.
Zahrievaním alfa formy, ktorá má väčšiu tendenciu sublimalizovať, ako topiť sa. Sublimar znamená presťahovanie sa od tuhého stavu do sódy priamo, bez toho, aby prešiel tekutým stavom.
Bod varu
Všetky formy toho3 Varte pri 44,8 ° C.
Hustota
Tak3 Kvapalina (gama) má hustotu 1 9225 g/cm3 pri 20 ° C.
Tak3 Plyn má hustotu 2,76 vzhľadom na vzduch (vzduch = 1), čo naznačuje, že je ťažší ako vzduch.
Tlak vodnej pary
SW3 Alfa = 73 mm Hg pri 25 ° C
SW3 beta = 344 mm Hg pri 25 ° C
SW3 Gama = 433 mm Hg pri 25 ° C
To znamená, že forma gama má tendenciu sa odparovať ľahšie ako beta a ako alfa.
Stabilita
Alfa forma je najstabilnejšia štruktúra, ostatné sú metastabilné, to znamená, že sú menej stabilné.
Chemické vlastnosti
Tak3 Energicky reaguje s vodou, čím sa dá kyselina sírová h2SW4. Pri reagovaní je veľmi teplo, takže vodná para sa rýchlo oddelí od zmesi.
Byť vystavený vzduchu3 rýchlo absorbujte vlhkosť a vyžaruje husté výpary.
Je to veľmi silné dehydratačné činidlo, to znamená, že ľahko eliminuje vodu z iných materiálov.
Síra SO3 Má afinitu k voľným elektrónom (tj elektróny, ktoré nie sú v spojení medzi dvoma atómami), takže má tendenciu tvoriť komplexy so zlúčeninami, ktoré ich majú, ako je pyridín, trimetylamín alebo dioxán.
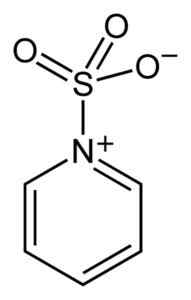 Komplex medzi oxidom síry a pyridínom. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Komplex medzi oxidom síry a pyridínom. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Tvorovaním komplexov si sulfur berie „požičané“ elektróny druhej zlúčeniny, aby uspokojili ich nedostatok. V týchto komplexoch je stále dostupný trik oxid3.
Je to silné sulfonantné činidlo organických zlúčenín, čo znamená, že slúži na ľahké pridanie skupiny -SO3- Do molekúl.
Ľahko reaguje s oxidmi mnohých kovov, aby poskytla sulfáty týchto kovov.
Je korozívny voči kovom, zvieratám a rastlinným tkanivám.
Tak3 Je ťažké zvládnuť materiál z niekoľkých dôvodov: (1) jeho bod varu je relatívne nízky, (2) má tendenciu tvoriť pevné polyméry pri teplotách menších ako 30 ° C a (3) má vysokú reaktivitu voči takmer všetkým organickým látkam A voda.
Môže vám slúžiť: amorfné tuhé látky: štruktúra, vlastnosti, príkladyMôže výbušne polymerizovať, ak neobsahuje stabilizátor a je tu prítomnosť vlhkosti. Ako stabilizátory sa používajú dimetylsulfát alebo oxid bóru.
Získanie
Získa sa reakciou pri 400 ° C medzi oxidom siričitého SO2 a molekulárny kyslík alebo2. Reakcia je však veľmi pomalá a na zvýšenie rýchlosti tejto rýchlosti sú potrebné katalyzátory.
2 SO2 + Ani2 ⇔ 2 SO3
Medzi zlúčeniny, ktoré urýchľujú túto reakciu, patrí Platino Metal Pt, vanadium pentoxid v2Ani5, Oxid železita2Ani3 a oxid dusnatý.
Žiadosti
Pri príprave oleja
Jedna z jej hlavných aplikácií spočíva v príprave kyseliny oleja alebo dymu sírovej, ktorá sa nazýva preto, že emituje viditeľné výpary voľným okom. Na jeho získanie, SO sa absorbuje3 V koncentrovanej kyseline sírovej H2SW4.
 Pu -sulfurické oleum alebo fajčenie. Z fľaše môžete vidieť biely dym vychádzajúci z fľaše. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Pu -sulfurické oleum alebo fajčenie. Z fľaše môžete vidieť biely dym vychádzajúci z fľaše. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Toto sa deje v špeciálnych vežiach z nehrdzavejúcej ocele, kde koncentrovaná kyselina sírová (ktorá je kvapalná)3 Plynky stúpajú hore.
Kvapalina a plyn prichádzajú do styku a spojte sa, čím sa vytvorí oleum, ktorá je mastnou tekutinou. Toto má zmes H2SW4 A tak3, ale má tiež molekuly kyseliny disulfurovej h2Siež2Ani7 a trisulfuric h2Siež3Ani10.
V chemických sulfonačných reakciách
Sulfonácia je kľúčovým procesom vo veľkých priemyselných aplikáciách na výrobu detergentov, povrchovo aktívnych látok, farbív, pesticídov a farmaceutických výrobkov.
Tak3 Slúži ako sulfonantné činidlo na prípravu sulfonovaných olejov a alkyl-angal-sulfonovaných detergentov, medzi mnohými ďalšími zlúčeninami. Nižšie je sulfonačná reakcia aromatickej zlúčeniny:
ARH + SO3 → Arso3H
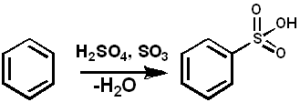 Benzén sulfonácia s3. Pedro8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Benzén sulfonácia s3. Pedro8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Pre sulfonačné reakcie je možné použiť oleum alebo tak3 vo forme svojich komplexov s pyridínom alebo trimetylamínom.
Pri extrakcii kovu
Plyn s3 Používa sa pri liečbe minerálov. Jednoduché oxidy kovov sa môžu stať oveľa rozpustnejšími sulfátmi, keď ich ošetríte3 pri relatívne nízkych teplotách.
Minerály síry, ako je pyrit (sulfid železa), trakt3 Umožňuje tieto kovy ľahko a za nízku cenu.
Sulfidy železa, niklu a medi reagujú s plyn3 Dokonca aj pri izbovej teplote, formovanie príslušných sulfátov, ktoré sú veľmi rozpustné a môžu byť podrobené iným procesom, aby sa získal čistý kov.
Na niekoľkých použitiach
Tak3 Slúži na prípravu kyseliny chlórsulfurovej tiež nazývaná HSO kyseliny chlorosulfónovej3Cl.
Oxid síry je veľmi silný oxidant a používa sa pri výbušnej výrobe.
Riziká
Do zdravia
Tak3 Je to vysoko toxická zlúčenina zo všetkých trás, tj vdýchnutia, požitie a kontakt s pokožkou.
Irrita a korody sliznice. Spôsobuje pokožku a oči. Jeho výpary sú veľmi toxické, keď sú vdýchnuté. Vyrábajú sa vnútorné popáleniny, dýchacie ťažkosti, bolesť na hrudníku a pľúcny edém.
Môže vám slúžiť: butanone: štruktúra, vlastnosti a použitia Sírus trikxid SO3 je veľmi žverší a nebezpečný. Autor: Openicons. Zdroj: Pixabay.
Sírus trikxid SO3 je veľmi žverší a nebezpečný. Autor: Openicons. Zdroj: Pixabay. Je to jedovaté. Jeho požitie vytvára silné popálenie, pažerák a žalúdok. Okrem toho je podozrivé, že je karcinogén.
Oheň alebo výbuch
Predstavuje nebezpečenstvo požiaru pri príchode do kontaktu s organickými materiálmi, ako sú drevo, vlákna, papier, olej, bavlna, najmä ak sú mokré.
Existuje tiež riziko, ak prídete do kontaktu so základňami alebo redukčnými agentmi. Kombinuje sa s vodou výbušne a tvorí kyselinu sírovú.
Kontakt s kovmi môže produkovať plynný vodík h2 čo je veľmi horľavé.
V sklenených nádobách by sa malo vyhnúť, aby sa zabránilo možnému násilnému prasknutiu nádoby.
Dopad na životné prostredie
Tak3 Považuje sa za jednu z najväčších znečisťujúcich látok prítomných v zemskej atmosfére. Je to kvôli jeho úlohe pri tvorbe aerosólov a jeho prínosom k kyslému dažďu (v dôsledku tvorby kyseliny sírovej H2SW4).
 Les poškodený kyslým dažďom v Českej republike. Lovecz [verejná doména]. Zdroj: Wikimedia Commons.
Les poškodený kyslým dažďom v Českej republike. Lovecz [verejná doména]. Zdroj: Wikimedia Commons. Tak3 Vytvára sa v atmosfére v dôsledku oxidácie oxidu siričitého SO2. Keď sa vytvorí SO3 To rýchlo reaguje s vodou za vzniku kyseliny sírovej H2SW4. Podľa nedávnych štúdií existujú ďalšie mechanizmy transformácie SOS3 V atmosfére, ale kvôli veľkému množstvu vody prítomnej v tomto, SO sa stále považuje za3 Hlavne prevedené na H2SW4.
Tak3 plynový alebo priemyselný plynný odpad, ktorý ho obsahuje. Je to extrémne reaktívny plyn a, ako už bolo uvedené vyššie, v prítomnosti vlhkosti vzduchu3 Sa stáva kyselinou sírovou h2SW4. Preto vo vzduchu SO3 pretrváva vo forme kyseliny sírovej tvoriace malé kvapôčky alebo aerosól.
Ak kvapky kyseliny sírovej vstúpia do dýchacieho traktu človeka alebo zvierat, rastú rýchlo v dôsledku vlhkosti, takže majú možnosť preniknúť do pľúc. Jeden z mechanizmov kyslej hmly H2SW4 (To je také3) Môže produkovať silnú toxicitu, pretože extracelulárne a intracelulárne pH živých organizmov (rastliny, zvieratá a ľudská bytosť) menia zmeny).
Podľa niektorých vedcov, tak hmla3 Je to príčinou nárastu astmatík v oblasti Japonska. Hmla3 Má veľmi korozívny účinok na kovy, takže kovové konštrukcie postavené ľudskou bytosťou, ako sú niektoré mosty a konštrukcie, môžu byť veľmi ovplyvnené.
Tak3 tekutina by sa nemala vyradiť v odtoku špinavých vôd alebo kanalizácií. Ak sa naleje do kanalizácií, môžete vytvoriť oheň alebo nebezpečenstvo výbuchu. Ak sa vyliaje náhodou, nemala by sa smerovať k produktu prúd vody. Nikdy by sa nemala absorbovať do piliny alebo iného absorpčného paliva, pretože môže generovať požiare.
Mal by sa absorbovať v suchom piesku, suchej pôde alebo iným úplne suchým inertným absorptom. Tak3 Nemalo by sa nalievať do životného prostredia a nikdy by sa s tým nemalo dostať do kontaktu. Malo by sa udržiavať ďaleko od zdrojov vody, pretože s tým produkuje kyselinu sírovú, ktorá je škodlivá pre vodné a pozemné organizmy.
Odkazy
- Sarkar, s. a kol. (2019). Vplyv amoniaku a vody na osud trioxidu siričitého v troposfére: teoretický výskum dráh tvorby kyseliny sírovej a kyseliny sírovej. J Phys Chem a.2019; 123 (14): 3131-3141. NCBI sa zotavila.NLM.NIH.Vláda.
- Muller, T.L. (2006). Kyselina sírová a trioxid sírovej. Kirk-Othmer Encyclopedia chemickej technológie. Zväzok 23. Zdroj: z online knižnice.Mravný.com.
- Alebo.Siež. Lekárska knižnica. (2019). Oxidová síra. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Kikuchi, r. (2001). Environmentálne riadenie imisie oxidu siričitého: Vplyv SO3 O ľudskom zdraví. Environmental Management (2001) 27: 837. Odkaz obnovený.Prubár.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Ismail, m.Jo. (1979). Extrakcia kovov zo sulfidov pomocou trioxidu siričitého v fluidizovanom lôžku. J. Chem. Technický. Biotechnol. 1979, 29, 361-366. Zdroj: z online knižnice.Mravný.com.
- « Geografia Malawi Lago, geológia, dôležitosť, fauna, Rios
- Štruktúra kyanidu sodného (NACN), vlastnosti, riziká, použitie »

