Štruktúra kyanidu sodného (NACN), vlastnosti, riziká, použitie

- 4395
- 1087
- Denis Škriniar
On Kyanid sodný Je to anorganická soľ tvorená sodíkom na katión+ a anión kyanidu cn-. Jeho chemický vzorec je NACN. Tiež známy ako kyanid sodný, je to biela kryštalická tuhá látka. Je hygroskopický, to znamená, že absorbuje vodu z životného prostredia a jej kryštály sú kubické, ako je napríklad chlorid sodný chlorid.
Pri rozpustení vo vode má tendenciu tvoriť kyanid vodíka HCN. Jeho roztoky ľahko rozpúšťajú zlato a striebro. Táto funkcia ju používa na extrahovanie zlata a striebra z minerálov. Riešenia používané na tento účel sa recyklujú, to znamená, že sa niekoľkokrát znovu použijú.
 Kyanid sodný sodný. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Kyanid sodný sodný. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Niektorým kyanidom sa však podarí uniknúť určitým odpadovým rybníkom, čo predstavuje nebezpečenstvo pre faunu a ľudskú bytosť, pretože kyanid je veľmi toxický a môže spôsobiť smrť.
NACN sa používa v chemickom priemysle ako sprostredkovateľ na prípravu niekoľkých typov zlúčenín, ako sú farbivá, chemikálie na poľnohospodárstvo a lieky alebo lieky.
Kyanid sodný je veľmi nebezpečná zlúčenina, pretože môže spôsobiť smrť, takže sa musí manipulovať s extrémnou opatrnosťou.
[TOC]
Štruktúra
Kyanid sodný je tvorený iónom Na+ a iónom CN-.
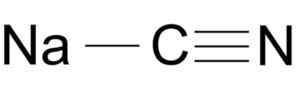 Štruktúra molekúl sodného NACN. Arrowsmaster [verejná doména], zdroj: Wikimedia Commons.
Štruktúra molekúl sodného NACN. Arrowsmaster [verejná doména], zdroj: Wikimedia Commons. Kyanidový ión má automobil a jeden z dusíka n sa navzájom spája s trojitým odkazom.
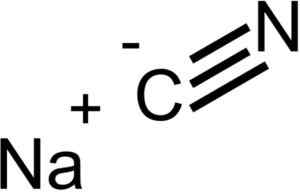 Ióny, ktoré tvoria kyanid sodný NACN. EPOP [verejná doména]. Zdroj: Wikimedia Commons.
Ióny, ktoré tvoria kyanid sodný NACN. EPOP [verejná doména]. Zdroj: Wikimedia Commons. NACN má rovnakú kryštalickú štruktúru ako NaCl, takže jej kryštály sú kubické.
Menovanie
-Kyanid sodný
-Kyanid sodný
Vlastnosti
Fyzický stav
Hygroskopická biela kryštalická tuhá látka (absorbovať vodu z prostredia).
Molekulová hmotnosť
49 007 g/mol
Bod topenia
563,7 ° C
Bod varu
1496 ° C
Bod vzplanutia
Nie je to horľavé. Ale ak je vystavený požiaru, dochádza k kyanidu vodíka a oxidom dusíka.
Môže vám slúžiť: sublimácia: koncept, proces a príkladyHustota
1 595 g/cm3 pri 20 ° C
Rozpustnosť
Veľmi rozpustné vo vode: 48 g/100 ml pri 10 ° C, 82 g/100 ml pri 35 ° C. Mierne rozpustný v alkoholu
Disociačná konštanta
Je hydrolyzovaný vo vodnom roztoku generujúci kyanid vodíka HCN. Konštanta tejto hydrolýzy je Kh = 2,5 x 10-5.
pH
Vodné roztoky NACN sú silne zásadité
Chemické vlastnosti
Pri rozpustení vo vode sa oddeľuje vo svojich iónov+ a CN-. Vo vodnom roztoku kyanidový ión CN- Vezmite protón h+ voda h2Alebo formovanie HCN a OH ion-, Roztok sa teda stáva zásaditým.
CN- + H2O → HCN + OH-
Z tohto dôvodu sa ich vodné roztoky rozkladajú rýchlo tým, že zostávajú uložené a tvoria kyanid vodíka HCN.
Je korozívny voči hliníku. Jeho roztoky ľahko rozpustia Au a strieborné Ag v prítomnosti vzduchu.
Je to chelatačné činidlo, pretože anión kyanidu CN- Môže sa ľahko spojiť s inými kovmi, ako je striebro, zlato, ortuť, zinok, kadmium atď.
Predstavuje slabú vôňu horkých mandlí.
Riziká
Musí sa s nimi zaobchádzať veľmi opatrne. Je to vysoko jedovatá zlúčenina, inhibuje dôležité metabolické procesy a vedie k smrti pri požití, vdýchnutí, absorpcii kože alebo kontaktu s očami.
Ak je NACN vdýchnutý, rozpustí sa v sliznici respiračného traktu a prechádza do krvného obehu. Kyanidový ión NACN má silnú afinitu k železa v stave oxidácie +3, to znamená viera železitého katiónu3+.
Keď je kyanid absorbovaný, reaguje rýchlo s vierou3+ Dôležitého enzýmu mitochondrií buniek (oxidáza cytochróm), ktorý bráni vykonaniu určitých dýchacích procesov.
Preto je bunkové dýchanie inhibované alebo brzdenie a je cytotoxická hypoxia. To znamená, že bunky a tkanivá nie sú schopné používať kyslík, najmä mozgové a srdcové bunky.
Týmto spôsobom dochádza k trvalému alebo smrteľnému poškodeniu tela. Môže sa to stať u ľudí aj u zvierat.
Ak preťaženie krvných ciev a korózia žalúdočnej sliznice pochádza, okrem toho, čo už bolo spomenuté, okrem toho, čo už bolo spomenuté.
Môže vám slúžiť: Justus von Liebig Kyanid sodný NACN môže spôsobiť smrť. Autor: Openicons. Zdroj: Pixabay.
Kyanid sodný NACN môže spôsobiť smrť. Autor: Openicons. Zdroj: Pixabay. Nie je to palivo, ale v kontakte s kyselinami, uvoľňuje HCN, ktorý je vysoko horľavý a toxický.
Ak sa topí s dusičnanmi alebo chloróriami, môže sa využiť.
Získanie
Môže sa získať s sodným Na, amoniak nh3 a uhlie C. Sodík reaguje s amoniakom, ktorý dáva nanh sodný2:
2 na + 2 nh3 → 2 nanh2 + H2↑
Amid sodný sa zahrieva uhlíkom pri 600 ° C a produkuje kyanamid sodný na sodný2NCN, ktoré sa potom s uhlím pri 800 ° C stáva kyanidom sodným:
2 nanh2 + C → 2 h2↑ + NA2Ncn
Nat2NCN + C → 2 NACN
Ďalšou metódou je topenie vápnika a kyanamidu uhlia s uhličitanom sodným na2Co3:
CancN + C + NA2Co3 → Caco3 + 2 NACN
Môže sa tiež pripraviť prechodom plynným dusíkom n2 Pre horúcu zmes uhličitanu sodného2Co3 a uhlie prášku, použitie Faith Faith ako katalyzátora alebo urýchľovača reakcie:
Nat2Co3 + 4 c + n2 → 2 NACN + 3 CO ↑
Žiadosti
Pri extrakcii zlatých a strieborných minerálov. Dôsledky
Kyanid sodný sa už dlho používa na extrahovanie kovov zlata a striebra z minerálov.
Kyanid použitý v tomto procese sa recykluje, ale niečo unikne z odpadového rybníka spolu s ťažkými kovmi, ktoré sa nezískali.
Vtáky, netopiere a iné zvieratá, ktoré pijú z týchto lagún s kyanidom, boli otrávené.
Existujú záznamy o rumunskej priehrade, ktorá udržiavala izolovanú rybník a bol poškodený počasím.
V dôsledku toho sa do rieky Sasar a blízkych zvodnených systémov, ako sú Lapus, Somes, Tisza Rivers, končiace v Dunaji, prepustili tony kyanidu, ako sú Lapus, Somes, Tisza.
To spôsobilo vodopád úmrtí zvierat alebo inými slovami, ekologická katastrofa.
 Extrakcia zlata s kyanidom na Novom Zélande okolo roku 1918. Môžete vidieť množstvo kontaminovanej vody, ktorá bola prepustená v neďalekých riekach. Národná knižnica NZ na Commons [Žiadne obmedzenia]. Zdroj: Wikimedia Commons.
Extrakcia zlata s kyanidom na Novom Zélande okolo roku 1918. Môžete vidieť množstvo kontaminovanej vody, ktorá bola prepustená v neďalekých riekach. Národná knižnica NZ na Commons [Žiadne obmedzenia]. Zdroj: Wikimedia Commons. Pri výrobe iných chemických zlúčenín
Kyanid sodný sa používa pri syntéze rôznych typov organických zlúčenín.
Môže vám slúžiť: oxid sodný (NA2O): štruktúra, vzorec, vlastnosti, rizikáNapríklad pigmenty a farbivá sa pripravujú (vrátane optických leštíc), zlúčeniny na použitie v poľnohospodárstve alebo agrochemikáliách a rôznych farmaceutických výrobkoch.
Slúži tiež na získanie chelatačných alebo únosových činidiel kovových iónov.
Pri kyanidu sodného sa pripravujú zlúčeniny nazývané nitrily, ktoré pri ošetrení kyselinou kyselinou alebo alkalickým vodným roztokom umožňujú získať karboxylové kyseliny.
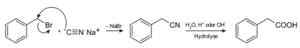 Príprava kyseliny karboxylovej pomocou kyanidu sodného NACN. Roland Mattern [verejná doména]. Zdroj: Wikimedia Commons.
Príprava kyseliny karboxylovej pomocou kyanidu sodného NACN. Roland Mattern [verejná doména]. Zdroj: Wikimedia Commons. Umožňuje pripraviť mastné kyseliny s kyanovými skupinami, kyanidmi ťažkých kovov a kyanidom vodíka HCN.
V kovovom priemysle
NACN sa používa v roztokoch používaných v galvanoplastike alebo kovovej elektróde (kovový náter s ostatnými), napríklad zinok.
Je súčasťou kalenej ocele. Podáva tiež pri čistení kovov.
Pri iných použitiach
Kyanid sodný je sprostredkovateľom pri výrobe nylonu.
Používa sa na oddelenie minerálov flotáciou s penou.
Aplikácie mimo používania, spochybnené alebo veľmi zriedkavé
Národ sa použil na odstránenie hlodavcov, ako sú králiky a potkany a ich nory, a na ukončenie hniezda termitov.
V súčasnosti sa občas používa na odstránenie kojotov, líšky a divých psov. Používa sa vo forme kapsúl ako jednoduchých alebo viacerých dávok v pastvinách, poľovníctve a lesoch.
Vďaka svojej extrémnej toxicite musí NACN používať iba pripravený ľudia.
Toto použitie sa považuje za veľmi nebezpečné pre ľudskú bytosť, ale existujú aj tí, ktorí ju stále používajú.
 Divoký život by sa nemal eliminovať, pretože tieto zvieratá už bojujú za prežitie v ťažkých podmienkach. Autor: maxwdhs. Zdroj: Pixabay.
Divoký život by sa nemal eliminovať, pretože tieto zvieratá už bojujú za prežitie v ťažkých podmienkach. Autor: maxwdhs. Zdroj: Pixabay. V poľnohospodárstve sa predtým používalo na fumimáciu citrusových ovocných stromov a iných ovocia. Používa sa tiež ako insekticíd a miticíd (eliminátor roztočov), ktorý sa aplikuje po zberu, na nevedené citrusy alebo na fumigáciu nákladných automobilov použitých na ich transport. Používa sa tiež na fumigovanie lodí, železničných automobilov a skladov.
Všetky tieto použitia boli spochybnené vysokou toxicitou kyanidu sodného. Z tohto dôvodu sa už nepoužíva alebo iba veľmi zriedka a za veľmi kontrolovaných podmienok.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Kyanid sodný. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Štvrté vydanie. John Wiley & Sons.
- Hurst, h.A. a Martin, m.D. (2017). Toxikológia. Kyanid. Vo farmakológii a terapeutike pre zubné lekárstvo (siedme vydanie). Zotavené z vedeckých pracovníkov.com.
- Coppock, r.W. a Dziwenka, m. (2015). Hrozby pre divočinu agentmi chemických bojov. V príručke toxikológie chemických vojnových agentov (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Morrison, r.Tón. a Boyd, r.N. (2002). Organická chémia. 6. vydanie. Hara.
- « Štruktúra oxidu siričitého (SO3), vlastnosti, riziká, použitie
- Štruktúra, vlastnosti, použitia, riziká, riziká oxidu bárnatého (BAO) »

