Charakteristiky Tptofánu, štruktúra, funkcie, výhody
- 947
- 276
- Denis Škriniar
On Tryptofán (TRP, W) je aminokyselina klasifikovaná v skupine esenciálnych aminokyselín, pretože ľudský organizmus ho nemôže syntetizovať a musí ju získať prostredníctvom diéty.
Niektoré potraviny, ako je mlieko a ich deriváty, mäso, vajcia a niektoré obilniny, ako napríklad quinoa a sója, obsahujú esenciálne aminokyseliny, a preto sú dôležitým zdrojom tryptofánu.
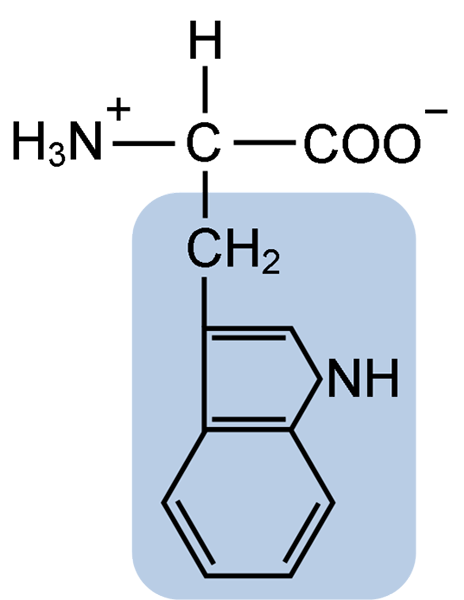
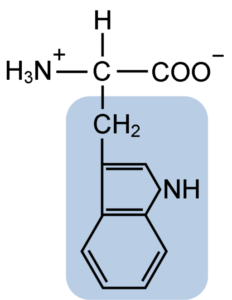 Chemická štruktúra aminokyseliny Tptofánu (zdroj: clavecin [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Chemická štruktúra aminokyseliny Tptofánu (zdroj: clavecin [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) V prírode je známych viac ako 300 rôznych aminokyselín a iba 22 tvorí monomérne jednotky bunkových proteínov. Medzi posledne uvedené, 9 sú esenciálne aminokyseliny vrátane tryptofánu, ale nevyhnutnosť každého z nich sa líši medzi jedným druhom a druhým.
Tryptofán má rôzne funkcie, z ktorých ich účasť na syntéze proteínov, na syntéze serotonínu, ktorý je silný vazokonstrikčný a neurotransmiter, melatonínu a v syntéze Co -Founder Nader Nader Nader Nader Nader Nader.
V rastlinnom kráľovstve je tryptofán základným prekurzorom rastlinného hormónu známy ako auxín (kyselina indol-3-octová). Môže byť syntetizovaný niektorými baktériami, ako sú napríklad A. coli Z Coristato, ktorý sa vyrába z niektorých glykolytických derivátov, ako je fosfoenolpiruvát a erytrosa-4-fosfát.
Jeho degradácia u cicavcov sa vyskytuje v pečeni, kde sa používa na syntézu acetyl koenzýmu A (acetyl-CoA), a preto je opísaná ako aminokyselina volá glukogénnu, pretože môže vstúpiť do cyklu tvorby glukózy.
Boli hlásené rôzne štúdie s kontroverznými výsledkami súvisiacimi s použitím tryptofánu ako doplnku výživy na liečbu niektorých patológií, ako je depresia a niektoré poruchy spánku.
Existujú niektoré choroby súvisiace s vrodenými defektmi v metabolizme aminokyselín. V prípade Tptofánu môže byť Hartnupova choroba menovaná v dôsledku tryptofánu -2,3 -monoxigázy, recesívne dedičné ochorenie, ktoré sa vyznačuje mentálnou retardáciou a zmenami typu typu kože typu pelagra.
[TOC]
Charakteristika
Spolu s fenylalanínom a tyrozínom sa tryptofán nachádza v skupine aromatických a hydrofóbnych aminokyselín.
Tryptofán sa však vyznačuje tým, že je mierne hydrofóbnou aminokyselinou, pretože je aromatický bočný reťazec, ktorý má polárne skupiny, zmierňuje túto hydrofóbnosť.
Na kombinované krúžky majú silnú absorpciu svetla v oblasti spektra blízko ultrafialového a tejto charakteristiky sa často používa na štrukturálnu analýzu proteínov.
Absorbuje ultrafialové svetlo (medzi 250 a 290 nm) a hoci táto aminokyselina nie je veľmi hojná v štruktúre väčšiny proteínov ľudského tela, jeho prítomnosť predstavuje dôležitý prínos pre absorpciu svetla v oblasti svetla v oblasti 280 nm väčšiny proteínov.
Typtofán Denné požiadavky sa líšia s vekom. U dojčiat od 4 do 6 mesiacov je priemerná požiadavka asi 17 mg na kilogram hmotnosti za deň; U detí vo veku 10 až 12 rokov je 3,3 mg na kilogram hmotnosti denne a u dospelých je 3,5 mg na kilogram hmotnosti za deň.
Tryptofán je absorbovaný črevnou cestou a súčasne je ketogénna a glykogénna aminokyselina.
Pretože je to prekurzor serotonínu, dôležitý neurotransmiter, tryptofán musí dosiahnuť centrálny nervový systém (CNS), a preto musí prekročiť bariéru v krvi, pre ktorý existuje špecifický aktívny transportný mechanizmus.
Môže vám slúžiť: Biggy Agar: Nadácia, príprava a použitieŠtruktúra
Tryptofán má molekulárny vzorec C11H12N2O2 a táto esenciálna aminokyselina má aromatický bočný reťazec.
Rovnako ako všetky aminokyseliny, aj tryptofán má atóm atómu uhlíka pripojený k aminoskupine (NH2), atómu vodíka (H), karboxylovej skupiny (COOH) a postranného reťazca (R) vytvoreného heterocyklickou štruktúrou, skupinou Indol Group.
Jeho chemický názov je kyselina 2-amino-3-propiónová, má molekulárnu hmotnosť 204,23 g/mol. Jeho rozpustnosť pri 20 ° C je 1,06 g v 100 g vody a má hustotu 1,34 g/cm3.
Funkcia
V ľudskej bytosti sa tryptofán používa na syntézu proteínov a je nevyhnutný pre tvorbu serotonínu (5-hydroxitriptamín) silný vazokonstriktor, ktorý stimuluje kontrakciu hladkého svalstva (najmä v MILINE Črevo) a neurotransmiter schopný generovať psychickú stimuláciu, bojovú depresiu bojovať a regulujte úzkosť.
Tryptofán je predchodcom syntézy melatonínu, a preto má dôsledky v spánkových a vigílnych cykloch.
Uvedená aminokyselina sa používa ako predchodca v jednom z troch spôsobov tvorby NAD kofaktora, veľmi dôležitého kofaktora, ktorý sa podieľa na rôznych enzymatických reakciách súvisiacich s oxid-redukčnými udalosťami.
Tryptofán a niektoré z jeho prekurzorov sa používajú na tvorbu vegetačného hormónu nazývaného auxín (kyselina aktívna indol-3). Auxíny sú rastlinné hormóny, ktoré regulujú rast, vývoj a mnoho ďalších fyziologických funkcií rastlín.
Biosyntéza
V organizmoch schopných syntetizáciou sa uhlíková kostra tryptofánu pochádza z fosfoenolpyruvátu a erytrosa-4-fosfátu. Tieto sú zase tvorené sprostredkovateľom cyklu Krebs: oxalacetát.
Fosfoenolpiruvát a erythrous-4-fosfát sa používajú na syntézu korizmátu na siedmich enzymatickej ceste. Fosfoenolpiruvát (PEP) je produkt glykolýzy a erytrózne-4-fosfát penóza fosfátovej cesty.
Aká je cesta syntézy korizmátu?
Prvým krokom symptómov Corismato je spojenie PEP s erytrosa-4-fosfát za vzniku 2-Zo-3-Disoxxi-D-Anabino-heptulosonato-7-fosfátu (DAHP) (DAHP) (DAHP) (DAHP).
Táto reakcia je katalyzovaná enzýmom 2-Zo-3-dexxi-D-Anabino-heptulosonato-7-fosfát syntázou (DAHP syntasa), ktorá je inhibovaná korizmátom.
Druhá reakcia naznačuje Cicláciu DAHP dehydrochinátom syntázy, enzýmu, ktorý vyžaduje ko -faktorový NAD, ktorý sa počas tejto reakcie zníži; Výsledkom je, že sa vyskytuje 5-dishydroquin.
Tretí krok tejto trasy znamená elimináciu molekuly vody 5-dehydroquinátu, reakcia katalyzovaná enzýmom dehydratázou dehydrochinátu, ktorej konečný produkt zodpovedá 5-Dishydro shikimatoto.
Keto skupina tejto molekuly sa rederuje na hydroxylovú skupinu a v dôsledku toho sa vytvorí shikimato. Enzým, ktorý katalyzuje túto reakciu, je NADPH-dependentná závislosť.
Piaty krok trasy znamená tvorbu 5-fosfátového shikimatu a konzumáciu molekuly ATP enzýmom známym ako kinázový shikimato, zodpovedný za fosforyláciu shikimatu v polohe 5.
Následne z 5-fosfátového shikimatu a pôsobením 3-enlappiruvil shikimato-5-fosfátu syntázy sa generuje 3-enlappiruvil shikimato 5-fosfát. Vyššie uvedený enzým podporuje vytesnenie fosforylovej skupiny druhej molekuly PEP hydroxylovou skupinou uhlíka v polohe 5 5-fosfátovej shikimate.
Môže vám slúžiť: Prečo je dôležité postarať sa o biodiverzitu?Siedma a posledná reakcia je katalyzovaná syntázou korizmom, ktorý eliminuje fosfáty z 3-enlappate shikimate 5-fosfátu a robí ho koristom.
V hube N. Crassa, Jeden multifunkčný enzymatický komplex katalyzuje päť zo siedmich reakcií tejto trasy a tento komplex sa pridávajú tri ďalšie enzýmy, ktoré nakoniec vytvárajú tryptofán.
Syntéza tryptofánu v baktériách
V A. coli, Transformácia tryptofánu Corism zahŕňa päť ďalšej enzymatickej trasy:
Najprv enzým antranilát syntázy premieňa korizmát na antraniláciu. V tejto reakcii sa zúčastňuje molekula glutamínu, darovaná aminoskupinou, ktorá sa viaže na indolový kruh tryptofánu a stáva sa glutamátom.
Druhý krok je katalyzovaný fosforribozyltransferázou antranilát. V tejto reakcii sa pyrofosfátová molekula 5-fosforribosyl-1-pyrofosfátu (PRPP) (PRPP) pohybuje bohatá na energiu a vytvára sa N- (5'-fosforribozyl).
Tretia reakcia tejto trasy syntézy tryptofánu znamená účasť enzýmu fosforribozyl-izomerázy. Tu n- (5'-forribosyl) -santrylát.
Neskôr sa tvorí indol-3-glycerolový fosfát v reakcii katalyzovanej indol-3-glycerolovou sympatickou syntázou, kde sa uvoľňuje molekula CO2 a H2O a 1- (O-karboxyfenylamín) -1-deoribulosa 5-fosfát.
Posledná reakcia tejto trasy skončí vytvorením tryptofánu, keď katalyz tryptofán syntázy.
Degradácia
U cicavcov je tryptofán degradovaný v pečeni na acetyl-CoA na trase, ktorá zahŕňa dvanásť enzymatických krokov: osem na dosiahnutie a-Zo-toadipate a 4 ďalšie, aby sa premenila a-zo-dotadipato na acetyl koenzým na acetyl koenzým na acetyl koenzým k.
Poradie degradácie, kým a-ceadadoadipato je:
Tptofán → N-Quinurenín formil → chinurenín → 3-hydroxi chinurenín → 3-hydroxy-antranilát → ε-semimaldehyd 2-amino-3-muconcycix veľa → ε-semildehido a-amino amouz amouz.
Enzýmy, ktoré katalyzujú tieto reakcie, sú:
Tptofán 2-3-dioxigenáza, formamidázový chinurenín, NADPH-dependentná monooxigenáza NADPH závislá.
Akonáhle sa vytvorí a-cethoadoadipát, oxidačná dekarboxylácia sa vytvorí gluterálna-CoA. Toto, pomocou ß-oxidácie, forma glutaconyl-CoA, ktorá stráca atóm uhlíka z bikarbonátu (HCO3-), vyhráva molekulu vody a končí ako crotonil-coa.
Crotonil-CoA, tiež na ß-oxidáciu, poskytuje acetyl-CoA. Uvedená acetyl-CoA môže nasledovať niekoľko spôsobov, medzi ktorými glukoneogenéza vytvára glukózu a cyklus Krebs, aby sa podľa potreby vytvoril ATP.
Táto molekula však môže byť tiež zameraná na tvorbu ketónových telies, ktoré sa konečne môžu použiť ako zdroj energie.
Potraviny bohaté na tryptofán
Červené mäso Všeobecne sú kuracie mäso a ryby (najmä modré ryby, ako je losos a tuniak), obzvlášť bohaté na tryptofán. Mlieko a jeho deriváty, vajcia, najmä žĺtok, sú tiež potraviny s množstvom obsahu tryptofánu.
Ďalšie potraviny, ktoré slúžia ako prírodný zdroj tejto aminokyseliny, sú:
- Orechy ako orechy, mandle, pistácie a anakros.
- Ryžové obilniny.
- Suché zrná, ako sú fazuľa, šošovica, cícer, sójové bôby, quinoa atď.
- Pivné kvasinky a čerstvé fazule, banány a banány, ananás alebo anána, avokádo, slivky, žerucha, brokolica, špenát a čokoláda.
Môže vám slúžiť: Submarine Shark: História, realita alebo fikcia?Výhody vášho príjmu
Spotreba typu Tptofan je absolútne nevyhnutná na syntézu všetkých tých proteínov, ktoré ich zahŕňajú do svojej štruktúry a prostredníctvom rôznych funkcií, umožňuje reguláciu nálady, spánkových a vigílnych cyklov a širokej škály biochemických procesov, v ktorých sa NAD zúčastňuje.
Okrem známych účinkov na náladu zasahuje serotonín (odvodený z tryptofánu) do viacerých kognitívnych funkcií týkajúcich sa učenia a pamäti, ktoré preto súvisia aj s tryptofánom.
Existujú údaje, ktoré ukazujú vzťah medzi náladou, serotonínom a gastrointestinálnou a-cerebrálnou osou ako systém obojsmerných vplyvov medzi emocionálnymi a kognitívnymi centrami mozgu a periférnou funkciou tráviaceho traktu.
Použitie ako doplnok výživy na liečbu niektorých porúch, najmä tie, ktoré súvisia s centrálnym nervovým systémom, bolo veľmi kontroverzné, pretože jeho konkurenčný transport s neutrálnymi aminokyselinami, oveľa hojnejší, sťažuje dosiahnutie významného a trvalého zvýšenia tryptofánu po tryptofáne po jeho perorálna správa.
Napriek týmto kontroverziou sa jeho použitie posielalo ako doplnok v:
- Liečba bolesti
- Poruchy spánku
- Depresia
- Liečba mánie
- Redukcia
Poruchy nedostatku
Centrálna eliminácia alebo nedostatok tryptofánu je sprevádzaný depresiou, zlyhaniami pozornosti, znížením pamäť, spánku a úzkostných porúch.
U depresívnych pacientov a so samovražednými trendmi sa našli zmeny v koncentrácii krvi a mozgovomiechového moku. Okrem toho niektorí pacienti s nervovou anorexiou vykazujú nízke hladiny tryptofánu v sére.
Niektorí polyurickí pacienti, ktorí strácajú vitamín B6 a zinok, majú často fóbie a úzkosť a zlepšujú sa s doplnkami výživy bohatých na triptofane.
Karcinoidný syndróm sa vyznačuje prítomnosťou nádorov tenkého čreva, ktoré spôsobujú hnačku, vaskulárne choroby a bronchokonstrikciu a súvisí s deficitom niacínu a trifánu
Pelagra je patologický stav, ktorý je sprevádzaný hnačkou, demenciou, dermatitídou a môže spôsobiť smrť, je to tiež liečené doplnkami niacínu a tryptofánu.
Hartnupova choroba musí robiť, medzi niektorými vecami, s defektom metabolizmu niekoľkých aminokyselín vrátane tryptofánu.
V prípade deficitu enzýmu typtofánu -2,3-monoxigázy je to recesívne dedičné ochorenie, ktoré sa vyznačuje mentálnou retardáciou a zmenami kože typu kožného typu.
Odkazy
- Halvorsen, K., & Halvorsen, s. (1963). Choroba. Pediatria, 31(1), 29-38.
- Kapucňa, s. D., Bell, C. J., Argyropoulos, s. Vložka., & Nutt, D. J. (2016). Donova panika. Sprievodca vyčerpaním tryptofánu s provokalizáciou úzkosti špecifickej pre poruchu. Journal of Psytopharmacology, 30(11), 1137-140.
- Jenkins, T. Do., Nguyen, J. C., Polglaze, K. A., & Bertrand, P. P. (2016). Vplyv tryptofánu a serotonínu na náladu a poznanie s možnou úlohou osi čreva-boin. Živiny, 8(1), 56.
- Kaye, w. H., Barbarich, n. C., Putnam, K., Gendall, K. Do., Fernstrom, J., Fernstrom, m.,… & Kishore, a. (2003). Anxiolytické účinky akútneho deplécie tryptofánu v anorexii nervosa. Medzinárodný denník porúch stravovania, 33(3), 257-267.
- Murray, r. Klimatizovať., Granner, D. Klimatizovať., Mayes, P., & Rodwell, V. (2009). Harperova ilustrovaná biochémia. 28 (P. 588). New York: McGraw-Hill.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.

