Charakteristiky prolíny, štruktúra, funkcie, jedlo
- 3528
- 821
- Alan Milota
Ten Prolína (Pro, p) patrí do 22 aminokyselín klasifikovaných ako základné. Je to neosenciálna aminokyselina, pretože ju môže syntetizovať človek a iné cicavcové zvieratá.
V roku 1900 bol nemecký vedec Richard Willstatter prvý, kto extrahoval a pozoroval prolinu. V roku 1901 však bol Emili Fischer, ktorý vytvoril výraz „prolín“ na základe pyrolidínového kruhu aminokyseliny; Tomuto výskumnému pracovníkovi sa podarilo podrobne vysvetliť syntézu prolínu z mliečneho kazeínu.
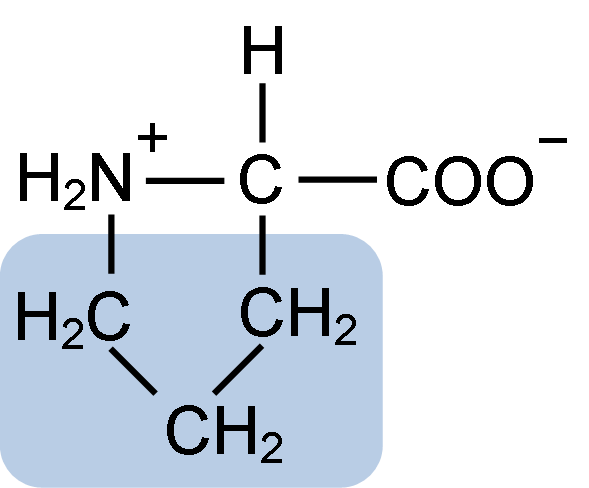
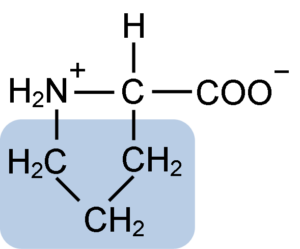 Chemická štruktúra prolínovej aminokyseliny (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Chemická štruktúra prolínovej aminokyseliny (zdroj: klavecín [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) V proteínoch, ako je kazeín, má prolín nevyhnutnú funkciu v „zákrutách“ a štrukturálnom skladaní. V tomto proteíne je prolín homogénne distribuovaný v celej štruktúre a súvisí s β kazeínom a proteínom aS1; Okrem toho zabraňuje defektným štrukturálnym slučkám alebo skladbám.
V biochemických analýzach použitých v súčasnosti na stanovenie presnej sekvencie aminokyselín, ktoré tvoria proteíny, je prolín jednou z najťažších detekčných aminokyselín, pretože sekundárna aminoskupina prolínu má odlišné správanie a nedá sa ľahko zistiť.
Skorbut je pravdepodobne najznámejšie ochorenie súvisiace s prolínom. To sa týka nedostatku príjmu vitamínu C, ktorý priamo ovplyvňuje hydroxyláciu prolínu v kolagénových vláknach, čo spôsobuje systémové oslabenie v dôsledku nestability kolagénových vlákien, ktoré sú v celom tele.
[TOC]
Charakteristika
Vďaka uhlíkovej sekundárnej aminoskupine α je úloha klasifikácie prolínu trochu zložitá. Avšak v niektorých textoch sa to klasifikuje vedľa rozvetvených aminokyselín alebo s alifatickými bočnými reťazcami, pretože bočný reťazec alebo r R prolín je hydrofóbny alebo alifatický.
Jednou z najdôležitejších charakteristík prolínu je to, že v žiadnom prípade sa nemôžu tvoriť vodíkové mosty, vďaka čomu je ideálnym na štruktúrovanie komplexných a zložitých zákrut v terciárnych štruktúrach proteínov.
Rovnako ako všetky aminokyseliny majú dve izoformy, ktoré závisia od centrálneho atómu uhlíka, prolín sa nachádza v prírode, ako je L-prolín alebo ako D-prolol. Forma L-Prolina má však najhojnejšiu povahu a je súčasťou proteínových štruktúr.
V proteínoch, kde sa nachádza, prolín často zaberá miesta v blízkosti povrchu alebo záhybu alebo „zákruty“ polypeptidového reťazca, pretože tuhá a uzavretá štruktúra prolínu sťažuje silnú interakciu s inými interakciami aminokyselinovej interakcie.
Štruktúra
Prolín má osobitnú štruktúru medzi základnými aminokyselinami, pretože predstavuje sekundárnu aminoskupinu (NH2) a nie primárnu aminoskupinu, ktorá je charakteristická pre všetky aminokyseliny.
Skupina R alebo laterálny reťazec prolínu je pyrolidín alebo tetrahydropirrolový kruh. Táto skupina je tvorená heterocyklickým amínom (bez dvojitých väzieb) piatich atómov uhlíka, kde každý z nich je nasýtený atómami vodíka.
Prolín má zvláštnosť, že „centrálny“ atóm uhlíka je zahrnutý do heterocyklického pyrolidínového kruhu, takže jedinými „voľnými“ alebo „vynikajúcimi“ atómami sú karboxylová skupina (COOH) a atóm vodíka (H) heterocyklického kruhu z heterocyklického kruhu aminokyselina.
Môže vám slúžiť: superoxid dysmutáza: Charakteristiky, štruktúra, funkcieMolekulárny vzorec prolínu je C5H9NO2 a jeho názov IUPAC je kyselina pirolidín-2-karboxylová kyselina. Má približnú molekulovú hmotnosť 115,13 g/mol a jeho frekvencia vzhľadu v proteínoch je približne 7%.
Funkcia
Vlákna kolagénu a tropocollagenu sú najhojnejšie proteíny u väčšiny zvierat stavovcov. Tieto tvoria pokožku, šľachy, kostnú matricu a mnoho ďalších tkanív.
Kolagénové vlákna sa skladajú z mnohých trojitých polypeptidových spúšťačov, ktoré sú zase zložené z viacerých prolínových a glycínových zvyškov v sekvencii glycín-praktolínu/hydroxiprololínu (druhý je modifikovaný derivát prolínu).
Prolín je vo svojej pôvodnej podobe súčasťou prokollagenu, čo je predchodcom polypeptidov kolagénu a niektorých ďalších proteínov spojivového tkaniva. Enzým prolín hydroxyláza.
Aká je hlavná funkcia prolínu v kolagénových vláknach?
Hydroxyprolín poskytuje charakteristiky rezistencie na kolagén, pretože tento derivát aminokyselín má schopnosť tvoriť veľké množstvo vodíkových mostov medzi trojitými vrtuľovými reťazcami, ktoré tvoria proteín.
Enzýmy, ktoré katalyzujú hydroxyláciu odpadu prolínu, vyžadujú prítomnosť vitamínu C (kyselina askorbová) a, ako je uvedené vyššie vodíkové mosty, ktoré udržiavajú kolagénové vlákna.
Iné funkcie
Prolín je nevyhnutný na tvorbu záhybu a proteínových zákrut.
Vďaka jeho uzavretej štruktúre sťažuje túto aminokyselinu, ktorá je ťažká „prispôsobiť“ vo vnútri proteínov, pretože nemôže tvoriť vodíkové mostíky, aby „interagovali“ s inými blízkymi odpadom, indukuje tvorbu „zákrut“ alebo „otáča“ pozdĺž štruktúry proteínov kde sa nachádza.
Všetky proteíny s krátkou životnosťou majú aspoň oblasť s hojným opakovaným prolínom, glutamátom, serínom a treonínom. Tieto regióny prechádzajú z 12 na 60 odpadov a nazývajú sa sekvencie škodcov.
Proteíny obsahujúce sekvenciu škodcov sú označené ubikvitináciou pre následnú degradáciu v proteozómoch.
Biosyntéza
Mnoho aminokyselín sa môže syntetizovať z sprostredkovateľov glykolýzy, fosforečnanu pentózy alebo cyklu kyseliny citrónovej (cyklus Krebs). Prolín a arginín sa tvoria na krátkych glutamátových trasách.
Prakticky bežná biosyntetická cesta pre všetky živé organizmy začína konverziou L-glutamátu v y-L-glutamil-5-fosfátu vďaka pôsobeniu glutamátu-5-chúlostivého enzýmu (v baktériách) alebo y-glutamil- Whinas (u ľudí).
Táto reakcia znamená fosforyláciu závislú od ATP, takže sa okrem hlavného produktu generuje molekula ADP.
Reakcia katalyzovaná glutamátom 5-SEMI-limiddehydrogenázou (v baktériách) alebo y-glutamilovým reduktánom fosfátom (u ľudí) premieňa y-l-glutamil-5-fosfát na L-glutamát-5-semi-limid prítomnosť Ko -faktor Nadph.
Môže vám slúžiť: Half Stuart: Nadácia, príprava a použitiaL-glutamato-5-semimálnydehyd je reverzibilný a spontánne dehydratovaný na (s) -1-1-pyrrool), v ktorej reakcii je tiež potrebná molekula NADPH alebo NADH.
Degradácia
Prolín, arginín, glutamín a histidín sa neustále degraduje na a-zetoglutarát, aby sa dostal do cyklu cyklu kyseliny citrónovej alebo Krebs. V konkrétnom prípade prolínu sa to prvýkrát oxiduje enzýmom prolín oxidázy na pirrolín-5-karboxylát.
V prvom kroku, kde sa vyskytuje oxidácia prolínu na pirrolín-5-karboxylát, sú oddelené protóny akceptované E-FAD, ktoré sa redukujú na E-FADH2; Tento krok je exkluzívny pre prolínovú aminokyselinu.
V dôsledku spontánnej reakcie sa pirrolín-5-karboxylát transformuje na y-semiálny glutamát, ktorý potom slúži ako substrát pre enzým glutamát y-SEMI-limidic dehydrogenázu. V tomto kroku sa objavia dva protóny, jeden z nich akceptuje NAD, ktorý je redukovaný na NADH, a druhý je voľný vo forme H+.
Arginín, rovnako ako prolín, sa transformuje na y-semimálny glutamát, ale prostredníctvom alternatívnej metabolickej trasy, na ktorej sa zúčastňujú dva rôzne enzýmy.
Y-semiálnydehyd glutamátový enzým dehydrogenáza transformuje glutamát y-semildehyd na L-glutamát L-glutamát. Následne je tento L-glutamát opäť oxidovaný enzýmom glutamátovou dehydrogenázou, ktorá nakoniec tvorí a-zetoglutarát, ktorý bude začlenený do cyklu kyseliny kyseliny citrónovej.
V oxidačnom priechode glutamátu sa uvoľní protón (H+) a aminoskupina (NH3+). Protón redukuje skupinu NADP+ a molekula NADPH vzniká.
Napriek početným podobnostiam, ktoré existujú medzi degradáciou a biosyntézovými cestami prolínu a arginínu, sú tieto aminokyseliny syntetizované a degradované úplne opačnými cestami, ktoré používajú rôzne enzýmy, rôzne kofaktory a ktoré sa vyskytujú rôznymi intracelulárnymi kompartmentmi.
Potraviny bohaté na Valinu
Všeobecne platí, že všetky potraviny s vysokým obsahom bielkovín majú veľké množstvo prolínu. Medzi nimi patrí mäso, mlieko, vajcia a ďalšie. Keď je však naše telo v optimálnom stave zdravia a výživy, je schopný syntetizovať prolín endogénny.
Prolín sa nachádza aj v mnohých strukovinách a orechoch a v celých zrnách, ako je napríklad ovsené vločky. Ďalšími prolínovými potravinami sú okrem iného pšeničné otruby, orechy, mandle, hrach, fazuľa.
Niektoré naturistické obchody zvyčajne formulujú komprimované z aminokyselín L-Lisina a L-Prololina, aby pomohli ľuďom s problémami s kĺbmi alebo na oneskorenie starnutia tkanív.
Nebolo však preukázané s istotou, že požitie výživových doplnkov týchto aminokyselín má významný vplyv na oneskorenie staroby alebo iných podmienok vopred veku.
Výhody vášho príjmu
Diéty bohaté na prolín sa zvyčajne predpisujú ľuďom, ktorí majú kĺbové choroby, ako je artritída, výrony, rozbitie väzov, dislokácie, šľachy a ďalšie, a to je kvôli ich vzťahu so syntézou kolagénových vlákien prítomných v telových spojivových tkanivách.
Môže vám slúžiť: agar m.R.S: Čo je, nadácia, príprava, používaMnohé farmakologické pleťové vody a tablety používané v estetickom priemysle sú obohatené o L-prolín, pretože niektoré štúdie ukázali, že táto aminokyselina môže nejako zvýšiť syntézu kolagénu a preto zlepšiť textúru kože, urýchliť hojenie rán, Lacerácie, vredy a popáleniny.
V potravinárskom priemysle existujú bielkoviny, ktoré majú „bioaktívne peptidy“, ktoré cvičia mimo ich výživových vlastností. Tieto peptidy majú vo všeobecnosti dva až deväť aminokyselinových odpadov, medzi ktorými sa oplýva prolínom, arginínom a lyzínom.
Tieto bioaktívne peptidy môžu mať antihypertenzívnu aktivitu s určitým opioidným účinkom; Môžu pôsobiť ako imunomodulátory stimuláciou imunitnej reakcie proti niektorým patogénom a môžu dokonca spôsobiť zvýšenie vazoaktivity, čo zlepšuje obeh tých, ktorí ich konzumujú.
Poruchy nedostatku
Glutén je proteín prítomný v zrnách pšenice, ktorý spôsobuje zápal čreva. Ľudia, ktorí trpia „neznášanlivosťou lepku“, sú známi ako „celiakii“ a je známe, že tento proteín je bohatý na prolín a glutamín, ktorého proteolytická degradácia je pre ľudí s takým stavom ťažká.
Niektoré choroby súvisia so zlým skladaním dôležitých proteínov a je veľmi bežné, že tieto defekty súvisia s izomerizáciou Cis-previesť Amida Links in prolínový odpad, pretože na rozdiel od iných peptidových väzieb, v ktorých izomér previesť Je to veľmi obľúbené, v prolíne je znevýhodnený.
V odpadu prolínu sa zistilo, že existuje významná tendencia k tvorbe izoméru Cis Po prvé ako izomér previesť V susedných amidách s odpadom z prolínu, ktorý môže vytvárať „nesprávnu“ konformáciu proteínov.
Metabolické poruchy
Rovnako ako v prípade iných základných a neosenciálnych aminokyselín, hlavné patologické poruchy súvisiace s prolínom musia robiť, zvyčajne s defektmi na asimilačných trasách tejto aminokyseliny.
Napríklad hyperprolinémia je typickým prípadom deficitu v jednom z enzýmov, ktoré sa podieľajú na trase degradácie prolínu, konkrétne v 1-pyrolín-5-karboxylátovej dehydrogenáze, čo vedie k akumulácii jeho substrátu, ktorá nakoniec neaktívna cesta.
Táto patológia je zvyčajne diagnostikovaná vysokým obsahom prolínu v krvnej plazme a prítomnosťou metabolitu 1-pyrrolin-5-karboxylátu u postihnutých močom postihnutých pacientov.
Hlavné príznaky tohto ochorenia pozostávajú z neurologických porúch, chorôb obličiek a straty sluchovej kapacity alebo hluchoty. Medzi ďalšie závažnejšie prípady patrí závažné mentálne oneskorenie a výrazné psychomotorické ťažkosti.
Odkazy
- Abu-Baker, s. (2015). Preskúmanie biochémie: Koncepty a spojenia
- Delauney, a. J., & Verma, D. P. Siež. (1993). Biosyntéza prolínu a osmoregulácia v rastlinách. The Plant Journal, 4 (2), 215-223.
- Zoznam, b., Lerner, r. Do., & Barbas, C. F. (2000). Priame asymetrické aldolové reakcie katalyzované prolínom. Journal of American Chemical Society, 122 (10), 2395-2396
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.
- Plimmer, R. H. Do. (1912). Chemická konštitúcia proteínov (zv. 1). Longmans, zelený.
- Szabados, L., & Savouré,. (2010). Prolín: multifunkčná aminokyselina. Trendy vo vede rastlín, 15 (2), 89-97.

