Kyslé základy Arrhenius, teórie Bronsted-Lowry, Lewis

- 1061
- 247
- JUDr. Rudolf Čapkovič
 Graf, ktorý sa týka troch hlavných teórií kyselín a základov. Zdroj: TEM5PSU, CC BY-SA 3.0, cez Wikimedia Commons
Graf, ktorý sa týka troch hlavných teórií kyselín a základov. Zdroj: TEM5PSU, CC BY-SA 3.0, cez Wikimedia Commons Čo sú kyslé a základné teórie?
Teórie kyseliny a základne sú súborom koncepčných príspevkov, ktoré definujú a diferencujú kyseliny a bázy, dva konglomeráty obrovských relevantných látok v oblasti chémie.
Jeho korene pochádzajú z prvých charakterizácií, ktoré urobil Robert Boyle v roku 1661, ktorý definoval kyseliny, ako sú kyslé a korozívne látky, ktoré menia farbu modrej na papier na červený pružinový papier; A základy, ako sú mydlové látky, ktoré na rozdiel od kyselín menia farbu červenej na papier.
Antoine Lavoisier navrhol, aby všetky kyseliny obsahovali atómy kyslíka, ako napríklad H2SW4 a hno3. Storočia neskôr v roku 1811 Humphry Davy zistil, že mnoho kyselín v skutočnosti nemalo atómy kyslíka, ako sú HCl, HF, HBR atď.
A krátko pred objavením slávnej trojitej trojice (vynikajúci obraz) Justig Liebig navrhol, že kyseliny majú atómy vodíka, ktoré môžu byť nahradené kovovými katiónmi.
Tieto empirické znalosti slúžili ako inšpirácia pre súčasné teórie kyselín a základní: Arrhenius, Bronsted-Lowry a Lewis. Ako je vidieť v grafe, Arrheniusova teória je najvýznamnejšou alebo obmedzenejšou zo všetkých, zatiaľ čo Lewis's je najbežnejším a globalizovanom.
Teória Arrhenius
Jeho teória, ktorú navrhol z roku 1884 Svante Arrhenius, hovorí, že kyseliny, keď sú rozpustené vo vode3Ani+ alebo h+; Zatiaľ čo základne, keď sa rozpúšťajú vo vode, produkujú alebo uvoľňujú OH ióny-.
Ióny H3Ani+ a oh- Kombinujú sa v reverzibilnej reakcii, ktorá vedie k vzniku molekúl vody:
H3Ani+ + Oh- ⇌ 2h2Ani
Môže vám slúžiť: kyselina disulfurová: čo je, štruktúra, vlastnosti, použitiaKyselina Arrhenius je tiež tá, ktorá zvyšuje koncentráciu H iónov3Ani+, Zatiaľ čo základňa Arrhenius je taká, ktorá zvyšuje koncentráciu iónov OH-.
To znamená, že kyselina Arrhenius by nemala nevyhnutne obsahovať H ióny3Ani+, A základňa Arrhenius nemusí mať OH ióny- Vo svojej štruktúre.
Príklad a obmedzenia
Zvážte nasledujúce disociácie:
HCl (AC) → H+(Ac) +cl-(Ac)
NaOH (AC) → NA+(Ac) +OH-(Ac)
HCl je kyselina Arrhenius, pretože keď sa rozpustí vo vode, produkuje H ióny+, alebo presnejšie, h ióny3Ani+. A na druhej strane, NaOH je základňa Arrhenius, pretože keď sa rozpustí vo vode, OH ióny vydávajú-. Tieto látky na seba navzájom reagujú a vyrábajú soľ a vodu:
HCl (ac) + NaOH (ac) → NaCl (ac) + h2Ani
Problém s teóriou Arrhenius spočíva v tom, že je obmedzený iba na vodné roztoky, a preto sa vzťahuje iba na látky, ktoré sú rozpustné vo vode. Napríklad MGO je vo vode veľmi nerozpustný, a napriek tomu je to základný oxid.
Tiež nie je schopné vysvetliť si, ako látky ako NH3 a Cao produkuje OH ióny- rozpustené vo vode, aj keď nemajú ióny, OH- Vo svojej molekulárnej alebo kryštalickej štruktúre (ako je v prípade NaOH alebo KOH).
A nevysvetľuje, ako CO2 môže uvoľniť ióny h3Ani+ Vo vode bez toho, aby ste v molekulárnej štruktúre mali atóm vodíka (ako je to v prípade HCl alebo H2SW4).
Teória Brönsted-Lowry
Návrh individuálne v roku 1923 Johannes Bronsted a Thomas Lewry, ich teória kyselín a základní hovorí, že kyselina je celá látka, ktorá môže darovať ióny h+, a že základňa namiesto toho je akákoľvek látka, ktorá je schopná prijať tieto h+. Táto teória je všeobecnejšia ako teória Arrhenius a pokrýva niekoľko jej obmedzení.
Môže vám slúžiť: Molar Solutions: Concept, príprava, príkladyPríklad
Zvážte znova neutralizačnú rovnicu medzi H3Ani+ a oh- Na výrobu dvoch molekúl vody:
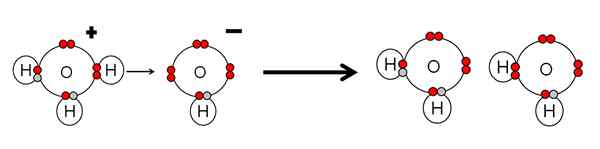 Príklad neutralizácie kyseliny a vodnej bázy. Zdroj: Gabriel Bolívar.
Príklad neutralizácie kyseliny a vodnej bázy. Zdroj: Gabriel Bolívar. Všimnite si, že h3Ani+ Urobil h+ ktorý bude okamžite prepojený alebo koordinovaný s OH- vpravo. Kedy h+ Končí sa spojené s jedným z párov bez elektrónov OH-, Dve neutrálne molekuly vody zostávajú ako výrobky.
H3Ani+ Preto je to kyselina Brnsted-Lowry, za darovanie H+, a oh- Je to základňa Brnsted Lowry na prijatie tohto h+.
Ďalším príkladom reakcie na báze kyseliny je nasledujúci:
NH3(G) + HCl (G) → NH4Cl (s)
Táto reakcia podľa Arrheniusu sa nedala považovať za typ kyseliny, pretože sa nedá vo vodnom médiu, ale vo fáze pary alebo v plynnom stave. NH3 Je to základňa Brnsted, pretože akceptuje HCl H darovaním niekoľkých elektrónov umiestnených na atóme dusíka; A HCl, logický, sa stáva kyselinou Brnsted.
MGO je teda základňou Brnsted, pretože je schopná prijať h+ kyselín na transformáciu na mg (OH)2.
Lewisová teória
Bronsted-Lowryho teória vysvetľuje široké spektrum reakcií na báze kyseliny. Ignorujte však tieto reakcie, kde H ióny+ a oh- Nie sú vôbec zapojení, ako aj väčšia účasť voľných elektrónov v molekulárnych mechanizmoch.
Tak, v roku 1923 g. N. Lewis navrhol teóriu kyslej bázy, ktorá hovorí: Kyselina je akákoľvek látka, ktorá je schopná akceptovať páry elektrónov, zatiaľ čo základňa je taká, ktorá daruje tieto elektrónové páry.
Môže vám slúžiť: DAPI (4 ', 6-diamidino-2-fenylindol): Charakteristiky, nadácia, použiteNapríklad ión h+ Je to kyselina Lewis, pretože prijíma elektrónové páry akéhokoľvek druhu v okolí: od H2Alebo pôvod H3Ani+, NH3 Na pôvod NH4+, atď.
Príklad a výhody
Zvážte ďalší príklad v nasledujúcej reakcii:
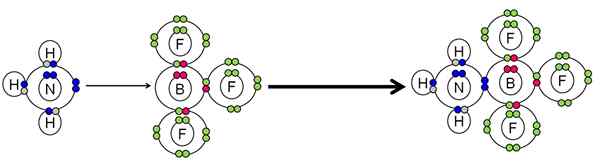 Príklad neutralizácie medzi kyselinou a Lewisovou základňou. Zdroj: Gabriel Bolívar.
Príklad neutralizácie medzi kyselinou a Lewisovou základňou. Zdroj: Gabriel Bolívar. NH3 Urobil pár elektrónov (modrá) atómu dusíka s atómom BF Boron3. Preto NH3 Je to základňa Lewisa, pretože daruje dvojicu elektrónov a BF3 Je to Lewisova kyselina, pretože ich prijíma.
Všeobecne platí, že katióny a zlé druhy elektrónov sú Lewisové kyseliny, zatiaľ čo anióny a druhy bohaté na elektróny sú Lewis Bases.
Ponúkané výhody.
Napríklad: h2O má voľné elektróny v kyslíku. Ak jedného z nich darujete ion h+, bude pôsobiť ako lewisová základňa, ktorá bude h+ Následne Lewisová kyselina.
Podľa Bronsted-Lowry, H2Alebo by som pôsobil ako základňa, pretože presne akceptuje h+ Darovaním niekoľkých bezplatných elektrónov. A nakoniec, h2Alebo je to tiež základňa podľa Arrheniusovej teórie, pretože koncentrácia H iónov klesá+ vo vodnom prostredí a následne zvyšovanie koncentrácie OH iónov-.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Clark Jim. (2002). Teórie kyselín a základní. Získané z: Chemguide.co.Uk
- Broderick C., Moussa m., & Clark J. (21. augusta 2020). Prehľad kyselín a základov. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Wikipedia. (2020). Reakcia kyseliny. Zdroj: In.Wikipedia.orgán
- Texas A&M University. (s.F.). Kyseliny a základy: Vývoj kyselín a základov. Získané z: Chem.tama.Edu

