Prepojenie vodíka
- 3041
- 178
- Mgr. Pravoslav Mokroš
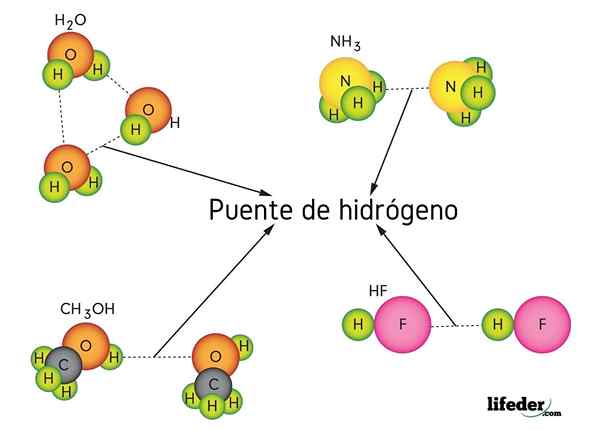
 Vodíkový most vo vode (h2O), metanol (CHO3OH), fluorid vodíka (HF) a amoniak (NH3)
Vodíkový most vo vode (h2O), metanol (CHO3OH), fluorid vodíka (HF) a amoniak (NH3) Čo je spojenie vodíkového mosta?
Väzba vodíkového mosta je špeciálny typ interakcie dipólu-dipolo, patriaci k silám Van der Waals, v ktorých sa atóm vodíka spája s dvoma alebo viacerými molekulami bez toho, aby bol kovalentný prepojený. Nehovorí sa o elektrónovom priestore, ale o hlavne elektrostatického javu.
Ako už názov napovedá, vodík pôsobí ako most, takže musí byť medzi dvoma atómami. Vodík je spojený (H-X) s veľmi elektronegatívnym atómom (ako je N, O a F) a priblíži sa k inému elektronegatívnemu atómu, ale zo susednej molekuly. To má za následok tvorbu vodíkového mosta X ··· H-X.
Všimnite si, že v reprezentácii X ··· H-X body symbolizujú vodíkový most, zatiaľ čo skript predstavuje kovalentnú väzbu medzi H a X. To znamená, že sa pozrime na vodíkový mostík medzi dvoma molekulami vody, kde X je atóm kyslíka: H2Alebo ··· H-OH (nižší obrázok).
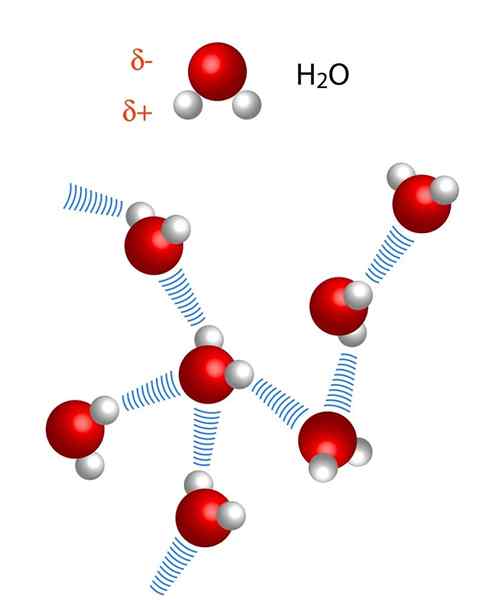
Na obrázku vyššie vidíme, že sedem molekúl vody zostáva spolu vďaka svojim vodíkovým mostom, ktoré predstavujú modré čiary. Samotný vodíkový most nie je príliš silný, ale keď sú miliardy, dávajú záležitosti neobvyklé a neočakávané vlastnosti.
Charakteristiky vodíkového mosta
Kompozičný
Vodíkový most by mal byť skutočne reprezentovaný ako X '··· H-X, kde X je to, čo je známe ako darca vodíkového mosta, pretože je kovalentne spojený s vodíkom (dáva mu).
Medzitým je x 'akceptorom vodíkového mosta, ktorý je prítomný v susednej molekule (prijíma ju). Máme teda atóm darcu (X), vodík (H) a atóm akceptora (x ') skladajúcich vodíkový most (x' ··· h-x).
Geometrický
Keď myslíme na most, príde na myseľ ploché alebo klenuté povrchy. Pretože sa predpokladá, že odkazy sa nekrivujú, potom budeme mať dve vzdialenosti: x ·· h a h-x, ktoré tvoria vodíkový most x ··· h-x.
Môže vám slúžiť: nezvratná reakcia: Charakteristiky a príkladyMedzi týmito dvoma vzdialenosťami je uhol, ktorý je často 180 °; To znamená, že tri atómy nášho mosta spočívajú na rovnakej horizontálnej (alebo vertikálnej) čiare.
Ak sa uhol líši od 180 °, most x ··· h-x už nie je rovný alebo lineárny, ale získava ďalšie geometrie.
Na druhej strane, vzdialenosti vo vodíkových mostoch nie sú rovnaké. Vzdialenosť H-X je kratšia ako X ··· H, čo je možné vidieť na obrázku molekúl vody. Napríklad vzdialenosť H-X je zvyčajne 110 pm (1,10-12m), zatiaľ čo druhá vzdialenosť x ··· h je 160 hod.
Asociatívny
Špeciálna charakteristika vodíkového mosta je to, že umožňuje, aby molekuly boli navzájom oveľa viac spojené. Nechodia zo strany k inému ignorujúce. Preto v prsiach kvapalín stanovuje okamžitý poriadok; A v prípade pevných látok prispievajú k definícii ich kryštálov.
Tam, kde vidíme vodíkový most, dokážeme myslieť na spojenie, a preto v určitom poradí (hoci dynamický a meniaci sa) na molekulárne stupnice.
Energia
Prelomenie vodíkového mosta nie je príliš ťažké. Molekuly vody, napríklad chodiť a vytvárať zakaždým pri mobilizácii. Ale prelomenie mnohých z nich by znamenalo porušenie nekonečného počtu molekúl. Hovoríme o dodávaní takej energie, ktorá prelomí móly týchto vodíkových mostov (6.02 · 1023 X ··· h-x).
Sila vodíkového mosta sa teda líši v závislosti od identity a povahy molekúl. Napríklad sila vodíkového mosta alebo ··· H-O medzi vodou a alkoholom je 5 kcal/mol: na prelomenie móla tohto vodíkového mosta je potrebná 5 kcal energie.
Môže vám slúžiť: Chemické zmeny: Charakteristiky, príklady, typyPríklady vodíkových mostov
Vodná voda
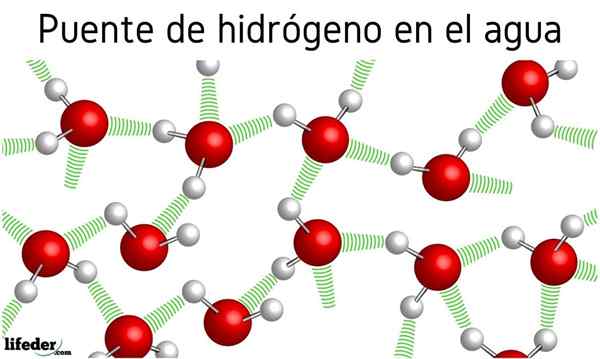
Spočiatku sa hovorilo o vodíkových mostoch medzi molekulami vody, ale vplyv na ich vlastnosti nebol spomenutý. Vďaka im voda varí pri 100 ° C, takže body varu príbuzných molekúl ako H2S, ktorá vrie na -60 ° C; alebo h2Ja viem, uvarím sa na -41.25 ° C.
Tento priepastný rozdiel je spôsobený mostíkmi vodíka, ktoré tiež definujú iné z ich neobvyklých vlastností, ako sú ich obrovské špecifické teplo, ľadové kryštály, ich dielektrická konštanta atď.
Etanol
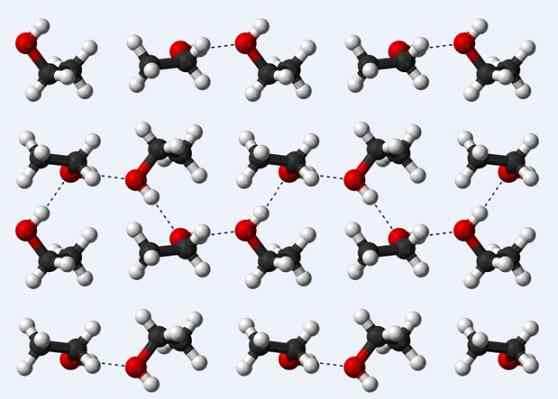 Vodíkové mosty v kryštáli etanolu
Vodíkové mosty v kryštáli etanolu Teraz sa pozrime na ďalší vodíkový most: ten medzi molekulami etanolu, ch3Chvály2Oh (hore). Všimnite si, ako sú molekuly ubytované3Chvály2Ach takým spôsobom, že sú stanovené ich vodíkové mosty3Chvály2Ho ··· Hoch2Chvály3 (bodkované čiary).
Molekuly sú však príliš nariadené, aby predpokladali, že hovoríme o tekutom etanole, ale namiesto toho tvoria sklo (solídny etanol).
Vodíkový most opísaný pre etanol je podobný ako u ostatných alkoholov, s rozdielom, že ich uhličité kostry môžu brániť účinnosti uvedených mostov.
Octová kyselina
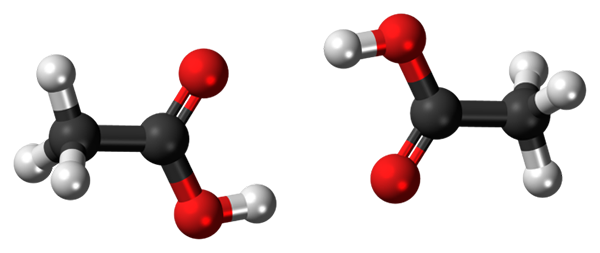 Vodíkové mosty medzi dvoma molekulami kyseliny octovej. Zdroj: Jynto, CC0, cez Wikimedia Commons
Vodíkové mosty medzi dvoma molekulami kyseliny octovej. Zdroj: Jynto, CC0, cez Wikimedia Commons Kyselina octová, Cho3COOH, je schopný vytvoriť dva mosty vodíka, ktoré spájajú dve molekuly súčasne. Pretože sú to dve molekuly spojené s vodíkovými mostmi, hovoríme o diméri.
Všimnite si, že jedným z týchto vodíkových mostov je C = o ··· H-O a druhý O-H ··· O = C. Kyselina octová predstavuje zvláštnosť, že v parnej fáze existuje ako tento dimér.
Môže vám slúžiť: manganická alebo kyselina permanganováCelulóza
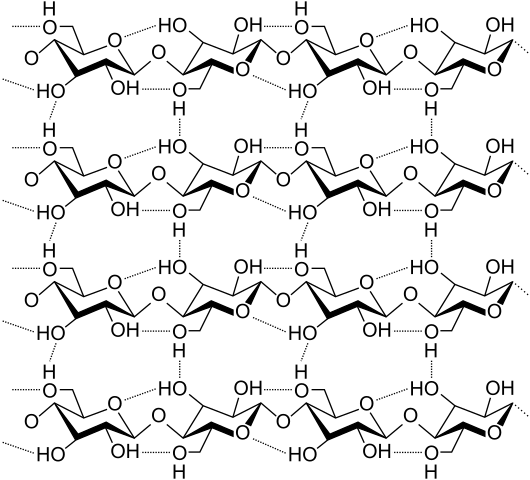 Vodíkové mosty medzi niekoľkými celulózovými reťazcami. Zdroj: Laghi.L, CC BY-SA 3.0, cez Wikimedia Commons
Vodíkové mosty medzi niekoľkými celulózovými reťazcami. Zdroj: Laghi.L, CC BY-SA 3.0, cez Wikimedia Commons Pozrime sa teraz rozmanitejšie a viac vodíkových mostov. Celulóza, prírodný polymér, pozostáva z reťazcov zložených z niekoľkých jednotiek p-glukózy.
Každý reťazec zostáva fixovaný na iný vďaka mnohým vodíkovým mostom (vynikajúci obraz), ktorý posilňuje súdržnosť medzi reťazami.
DNA
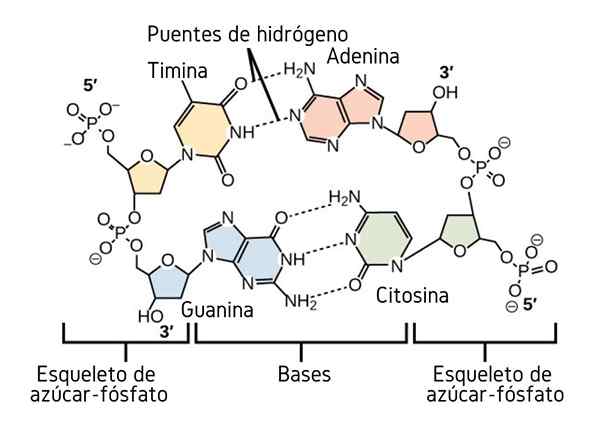 Vodíkové mosty medzi dusíkovými bázami DNA. Zdroj: CNX Openstax, CC BY 4.0, cez Wikimedia Commons
Vodíkové mosty medzi dusíkovými bázami DNA. Zdroj: CNX Openstax, CC BY 4.0, cez Wikimedia Commons Doteraz sme videli asociatívny účinok vodíkových mostov na uloženie poriadku medzi molekulami. Ale čo makromolekula? V makromolekule, ako je DNA, nachádzame vnútorné alebo intramolekulárne vodíkové mosty medzi jeho tymínom, adenínom, guanínom a cytozínom (nad) bázou (vyššie).
Intramolekulárne vodíkové mosty medzi týmito dusíkovými dami. Ak sú tieto vodíkové mosty prerušené zahrievaním, dvojitá vrtuľa sa otvorí v dvoch jednotlivých segmentoch alebo pásoch.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Edward E. Ávila a asilé j. Černošský. (2004). Vodíkový most a jeho aplikácie prepojia. University of Los Andes, fakulta vied, Katedra chémie.
- Wikipedia. (2020). Vodíková väzba. Zdroj: In.Wikipedia.orgán
- Pietri j. & Clark J. (21. augusta 2020). Vodíková väzba. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Redaktori Enyclopaedia Britannica. (2020). Vodíková väzba. Získané z: Britannica.com
- HelMestine, Anne Marie, PH.D. (29. októbra 2020). Čo sú príkladom vodíkovej väzby? Zotavené z: Thoughtco.com

