Systémy teórie kolízie, energia, príklady
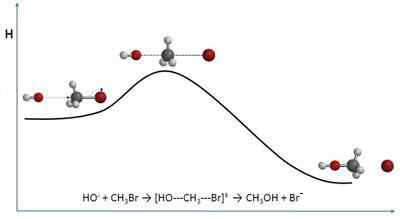
- 691
- 115
- Mgr. Pravoslav Mokroš
Ten teória zrážky Vysvetlite rýchlosti chemických reakcií z iba molekulárnej perspektívy. Preto je úzko blízko chemickej kinetiky. Namiesto toho, aby sa priblížili rýchlosti z hľadiska koncentrácií, robí to na základe kolíznych frekvencií.
Keď hovoríme o zrážkam, obraz niektorých biliardových loptičiek môže prísť na to, aby sa navzájom ovplyvnili na stôl. Molekuly, hoci táto teória predpokladá, že jej formy sú sférické, nepravte sa podobne. Molekulárne zrážky sa líšia niekoľkými spôsobmi, priestorové aj energia.

Táto teória, hoci to môže byť matematicky trochu zložitá a vykazuje značné variácie týkajúce sa experimentálnych výsledkov, ponúka obraz viditeľných interpretácií a bez abstraktných aspektov.
Aj keď sa používa pre plynné systémy alebo veľmi zriedené riešenia, jej princípy sa môžu rozšíriť na akékoľvek reakčné a fyzické médium.
[TOC]
Podmienky pre reakcie sa vyskytujú
Podľa teórie kolízií existujú tri podmienky, aby sa vyskytli reakcie:
- Chemické druhy (ióny, molekuly, radikály atď.) Musia sa efektívne zraziť.
- Musia niesť dostatok energie na rozdelenie svojich prepojení.
- Okrem toho musí byť orientácia na náraz veľmi špecifická.
Molekulárne zrážky
 Rovnako ako v bowlingu, reakcie sa uskutočňujú iba vtedy, keď dôjde k účinným zrážkam z hľadiska energie a vedenia
Rovnako ako v bowlingu, reakcie sa uskutočňujú iba vtedy, keď dôjde k účinným zrážkam z hľadiska energie a vedenia Molekulárne zrážky zdieľajú niečo spoločné s makroskopickými: vyskytujú sa prevažne medzi dvoma druhmi alebo telami. Dva biliardové lopty sa stretávajú medzi sebou, ako aj futbalový loptu proti stene alebo dva projektily uprostred vzduchu. To znamená, že zrážky týkajúce sa chémie a jej reakcií majú tendenciu byť bimolekulárny typ.
Môže vám slúžiť: ionizácia vo fyzike a chémii: koncept, proces a príkladyMolekuly nie sú stále, ale pohybujú sa a otáčajú sa priestorom, ktorý ich obklopuje. Pritom sa predpokladá, že kreslia druh kruhu nazývaného prierez, na ktorom existuje pravdepodobnosť, že iná molekula Colison. Podobne sa teória domnieva, že molekuly sú sférické na zjednodušenie matematických modelov.
Dve molekuly, hypoteticky sférické, sa môžu bez problémov zraziť, aj keď neexistuje chemická reakcia. Ale nestane sa to rovnakým spôsobom, pokiaľ ide o tri, štyri alebo viac molekúl.
Čím viac druhov by sa mali zraziť, aby vznikli produktom, tým je nepravdepodobnejší, že sa tento jav stáva. Toto sa vizuálne vysvetľuje a snaží sa, aby sa tri gule alebo projektily zrazili súčasne spolu. Preto sú bimolekulárne zrážky zďaleka najbežnejšie.
Systémy
Iba teória kolízie je platná pre softvérové systémy alebo fázy. Je to preto, že plyny vykazujú správanie, ktoré je možné dobre opísať ich kinetikou.
Pre tekuté fázy alebo veľmi zriedené roztoky sú reaktívne druhy zabalené do klietky na molekuly rozpúšťadla, s ktorou sa tiež zrážajú. Toto modifikuje panorámu, pretože reakcie závisia nielen od frekvencií kolízií, ale aj od difúzie molekúl reaktantu cez médium.
Zrážky
Molekuly sa môžu pomaly alebo veľmi rýchlo zraziť. Závisí to od toho, aká veľká energia, ktorá sa zase výrazne mení s teplotou. Čím silnejšia je zrážka, pravdepodobnosť, že dôjde k chemickej reakcii, sa zvýši, pretože táto energia môže prerušiť potrebné spojenia na vytvorenie nových.
Môže vám slúžiť: monoméryTáto energia je známa ako aktivácia aDo, A je charakteristická pre akúkoľvek chemickú reakciu. Keď sa teplota zvyšuje, priemer molekúl je schopný porovnávať alebo prekročiť eDo, Takže počet účinných kolízií, a preto sa tvoria výrobky.
V prítomnosti katalyzátora aDo klesá, pretože poskytuje povrchy a elektronické prostriedky, ktoré využívajú zrážky. Výsledok: Rýchlosť reakcie sa zvyšuje, bez zvýšenia teploty alebo pridaním ďalších činidiel.
Stérický faktor
Chemické druhy sa účinne zrážajú, aby reagovali a predpovedali túto teóriu, aká bude rýchlosť ich reakcií. Experimenty však ukázali, že čím zložitejšie sú štruktúry činidiel, tým väčšie sú odchýlky alebo rozdiely medzi teoretickými a experimentálnymi rýchlosťami.
Je to preto, že molekuly nie sú ani zďaleka sférické, ale priestorovo majú všetky druhy geometrie. Tu vstupuje stérický faktor, ρ, s ktorým sa snaží opraviť reakčné rýchlosti tak, aby boli predpovede teórie s experimentálnymi výsledkami lepšie.
Príklady reakcií
Bimolekulárna reakcia
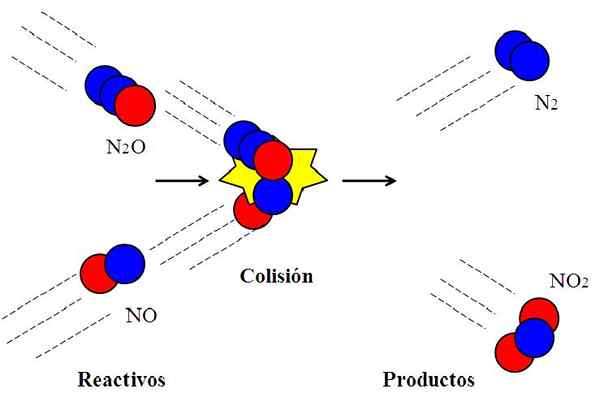 Účinná zrážka medzi oxidmi dusíka. Zdroj: Gabriel Bolívar.
Účinná zrážka medzi oxidmi dusíka. Zdroj: Gabriel Bolívar. Nasledujúca reakcia:
N2O + no → n2 + Nie2
Bežne sa používa na vysvetlenie, čo znamená efektívna orientácia pri molekulárnych zrážkach.
Molekula n2Alebo, oxid dyitrogénu, nebude reagovať s oxidom dusnatého NO, pokiaľ počas zrážky atóm kyslíka (červený kruh) N2Alebo šok priamo s atómom dusíka (modrý kruh) č. Iba týmto spôsobom budú produkty n pôvodne pôvodne2 a nie2; Inak n molekuly2O a nebudú sa odraziť bez reagovania.
Môže vám slúžiť: plynný stav: Charakteristiky, všeobecné právo, príkladyToto je príklad bimolekulárnej zrážky pre elementárnu bimolekulárnu reakciu. Aj keď majú činidlá dostatok energie na prelomenie odkazov, ak nie je orientácia vhodná, nedôjde k chemickej reakcii.
Unimolekulárna reakcia
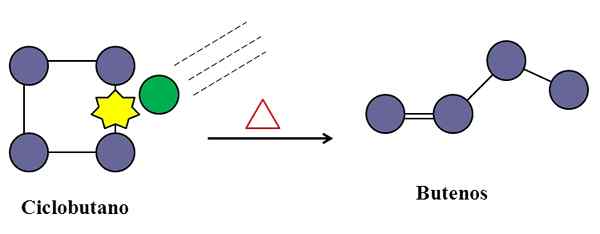 Zrážky sú tiež nevyhnutné pre cyklobutánovú izomerizáciu. Zdroj: Gabriel Bolívar.
Zrážky sú tiež nevyhnutné pre cyklobutánovú izomerizáciu. Zdroj: Gabriel Bolívar. Pri unimolekulárnej elementárnej reakcii môžu molekulárne zrážky zasiahnuť, aj keď je to iba druh, ktorý trpí transformáciou alebo rozkladom svojich väzieb.
Zoberme si napríklad izomerizáciu cyklobutánu, aby ste vznikli v zmesi butánov. Keď sa teplota zvyšuje, cyklobutánové molekuly budú vibrovať pri vyšších frekvenciách a zraziť sa s väčšou silou. Produkty však ukazujú, že dve cyklobutánové molekuly na seba nereagujú, pretože inak by produkovali zlúčeninu s ôsmimi uhlíkmi.
V strede môžu existovať nečistoty (zelený kruh), ktoré sa tiež zrážajú s cyklobutánom, konkrétne na ktoromkoľvek z jeho väzieb C-C. Môžu to byť ušľachtilé plyny alebo nie príliš reaktívne molekuly, ako je dusík.
Príde čas, keď sa nečistota zrazí s dostatočnou energiou na prelomenie jedného z c-c spojenia cyklobutánu. A potom sa jeho molekula snaží zmeniť usporiadanie a vzniknúť buuténu, ktorý je rozpoznateľný pre jeho dvojitú väzbu a štruktúru lineárneho reťazca.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Glasstón. (1970). Zmluva. Aguilar S. Do. edícií, Juan Bravo, 38, Madrid (Španielsko).
- Walter J. Moore. (1962). Fyzikálna chémia. (Štvrté vydanie). Longmans.
- Wikipedia. (2020). Teória zrážky. Zdroj: In.Wikipedia.orgán
- Redaktori Enyclopaedia Britannica. (2020). Teória zrážky. Encyclopaedia Britannica. Získané z: Britannica.com
- Clark Jim. (2018). KOLISKÁ TEÓRIA ODPADOVÝCH RIEŠENIA. Získané z: Chemguide.co.Uk
- Lawson P. A nižšie S. (18. mája 2020). Teória kolisie. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- « Charakteristiky didaktického textu, štruktúra, typy a príklady
- Krajiny a charakteristiky ostrovnej Ameriky alebo Antíl »

