História kremíka, vlastnosti, štruktúra, získanie, použitie

- 3009
- 288
- MUDr. Miloslav Habšuda
On kremík Je to nemetalický prvok a zároveň metaloid, ktorý predstavuje chemický symbol, ak je. Je to polovodič, ktorý je nevyhnutnou súčasťou počítačov, kalkulátorov, mobilných telefónov, solárnych článkov, diód atď.; Je to prakticky hlavná zložka, ktorá umožnila urovnanie digitálnej éry.
Silikón bol vždy prítomný v kremeňoch a kremičitanoch, oba minerály tvoriace okolo 28% hmotnosti celej zemskej kôry. Je to teda druhý najhojnejší prvok na povrchu Zeme a rozľahlosť púšte a pláží ponúka perspektívu toho, aký je hojný.
 Púšte sú hojným prírodným zdrojom častíc oxidu kremičitého alebo žuly s inými minerálmi. Zdroj: pxhere.
Púšte sú hojným prírodným zdrojom častíc oxidu kremičitého alebo žuly s inými minerálmi. Zdroj: pxhere. Silikón patrí do skupiny 14 periodickej tabuľky, rovnako ako uhlík, ktorý sa nachádza pod týmto. Preto sa tento prvok považuje za tetravalentný metaloid; Má štyri elektróny vo Valencii a teoreticky ich môžete stratiť, aby ste vytvorili katión, ak4+.
Vlastnosť, ktorá zdieľa s uhlím, je jej schopnosť zreťaziť; to znamená, že ich atómy sú kovalentne spojené s definovaním molekulárnych reťazcov. Podobne si kremík môže vytvoriť svoje vlastné „uhľovodíky“, nazývané Siltans.
Prevažujúcimi zlúčeninami kremíka v prírode sú slávne kremičitany. Vo svojej čistej podobe sa môže vyskytnúť ako pevný monokryštalický, polyristalín alebo amorfný. Je to relatívne inertná pevná látka, takže nepredstavuje značné riziká.
[TOC]
História
Kremíkový kameň
Silikón je pravdepodobne jedným z prvkov, ktorý mal najväčší vplyv na históriu ľudstva.
Tento prvok je protagonistom doby kamennej a tiež digitálnej éry. Ich pôvod sa darí, keď civilizácie spolupracovali s Quartzom a vytvorili si vlastné sklo; A v súčasnosti je hlavnou súčasťou počítačov, notebookov a smartfónov.
Prakticky kremík bol kameňom dvoch období jasne definovaných v našej histórii.
Izolácia
Keď bol oxid kremičitý tak hojný, meno zrodené z Flint Rock, musel obsahovať mimoriadne bohatý prvok v zemskej kôre; Toto bolo úspešné podozrenie na Antoine Lavoisier, ktorý v roku 1787 zlyhal pri pokusoch o zníženie ho z jej oxidu.
O niečo neskôr, v roku 1808, Humphry Davy urobil svoje vlastné pokusy a pridelil svoje krstné meno prvku: „Silicium“, ktorý by preložil ako „pederálny kov“. To znamená, že kremík bol v tom čase považovaný za kov kvôli nedostatku charakterizácie.
Potom v roku 1811 francúzski chemici Joseph L. Gay-Lussac a Louis Jacques Thénard sa podarilo prvýkrát pripraviť amorfný kremík. Z tohto. Nevyčistili sa však ani charakterizovali získaný produkt, takže nedospeli k záveru, že to bol nový prvok kremičitého.
Nebolo to nič iné ako v roku 1823, keď švédsky chemik Jacob Berzelius získal amorfný kremík s dostatočnou čistotou na to, aby ho rozpoznal ako kremík; Názov uvedený v roku 1817 škótskym chemikom Thomasom Thomsonom, keď sa to považuje za nemetalický prvok. Berzelius vykonal reakciu medzi draslíkom a fluorosilikátom draselného.
Kryštalický kremík
Kryštalický kremík bol pripravený prvýkrát v roku 1854 francúzskym chemikom Henry Deville. Aby sa to dosiahlo, Deville vyrobila elektrolýzu zmesi chloridov hliníka a sodného, čím získala kremíkové kryštály pokryté vrstvou hliníkového siciuro, ktoré ich eliminovali (zjavne) umývajú vodou vodou.
Fyzikálne a chemické vlastnosti
Fyzický vzhľad
 Elementárny kremík, ktorý má kovový lesk, ale v skutočnosti je to metalloid. Zdroj: Hi-RES Obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]
Elementárny kremík, ktorý má kovový lesk, ale v skutočnosti je to metalloid. Zdroj: Hi-RES Obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)] Silikón vo svojej čistej alebo elementárnej podobe pozostáva z modrošedej alebo čiernej pevnej látky (vynikajúci obraz), ktorý hoci nie je kovom, predstavuje jasné tváre, akoby to bolo skutočne.
Je to tvrdá, ale krehká pevná látka, ktorá tiež vykazuje skvamózny povrch, ak je tvorený Polyristales. Na druhej strane, amorfný kremík vyzerá ako tmavo hnedá prášková pevná látka. Vďaka tomu je ľahké identifikovať a rozlíšiť jeden typ kremíka (kryštalický alebo polyristalín) od iného (amorfný).
Molárna hmota
28.085 g/mol
Atómové číslo (z)
14 (14Áno)
Bod topenia
1414 ° C
Bod varu
3265 ° C
Hustota
-Pri teplote miestnosti: 2,33 g/ml
-Priamo v bode topenia: 2,57 g/ml
Všimnite si, že tekutý kremík je hustejší ako pevný kremík; Čo znamená, že ich kryštály sa vznášajú v kvapalnej fáze, rovnako ako v systéme ľadovej vody. Vysvetlenie je spôsobené skutočnosťou, že interatomický priestor medzi atómami, ak je v jeho skle väčší (menej hustý), ako zodpovedajúce v tekutine (hustejšia).
Fúzne teplo
50,21 kJ/mol
Odparovanie
383 kj/mol
Kapacita moláru
19 789 J/(mol · k)
Elektronegativita
1,90 v Pauling Scale
Ionizačné energie
-Prvé: 786,5 kJ/mol
-Po druhé: 1577,1 kJ/mol
-Tretie: 3231,6 kJ/mol
Atómové rádio
111 PM (merané v ich príslušných diamantových kryštáloch)
Tepelná vodivosť
149 w/(m · k)
Elektrický odpor
2.3 · 103 Ω · m až 20 ° C
Mohs tvrdosť
6.5
Zreťazenie
Silikónové atómy majú schopnosť vytvárať jednoduché SI-Si odkazy, ktoré nakoniec definujú reťaz (si-si-si ...).
Táto vlastnosť sa prejavuje aj uhlíkom a síry; Avšak hybridizácie SP3 kremíka sú nedostatočné v porovnaní s ostatnými dvoma prvkami a ich orbitály 3p sú difúznejšie, takže prekrývanie orbitálov SP SP3 Výsledkom je slabší.
Môže vám slúžiť: exotermické a endotermické reakciePriemerné energie kovalentných väzieb Si-Si a C-C sú 226 kJ/mol a 356 kJ/mol, respektíve 356 kJ/mol. Preto sú odkazy SI-IF slabšie. Z tohto dôvodu kremík nie je základným kameňom života (ani síry). V skutočnosti je najdlhší reťazec alebo kostra, ktorý môže tvoriť kremík, zvyčajne štyri členovia (ak4).
Oxidácia
Silikón môže mať ktorékoľvek z nasledujúcich oxidačných čísel, za predpokladu, že v každom z nich je existencia iónov s ich príslušným zaťažením: -4 (áno4-), -3 (áno3-), -2 (áno2-), -1 (áno-), +1 (áno+), +2 (áno2+), +3 (áno3+) a +4 (áno4+). Zo všetkých sú -4 a +4 najdôležitejšie.
Napríklad -4 sa predpokladá v Siliciuros (mg2Áno alebo mg22+Jo4-); zatiaľ čo +4 zodpovedá oxidu kremičitého (SIO2 alebo ak4+Ani22-).
Reaktivita
Silikón je úplne nerozpustný vo vode, ako aj silné kyseliny alebo základne. Rozpúšťa sa však v koncentrovanej zmesi dusnatých a fluorhorických kyselín (HNO3-Hf). Podobne sa rozpúšťa v horúcom alkalickom roztoku, vyskytuje sa nasledujúca chemická reakcia:
Áno (s) + 2naoh (ac) + h2Alebo (l) => na2SIO3(Ac) + 2h2g)
Metasilikát sodný, NA2SIO3, Vytvára sa tiež, keď sa kremík rozpustí v uhličitene roztaveného sodného:
Áno (s) + na2Co3(L) => na2SIO3(L) + c (s)
Pri teplote miestnosti vôbec nereaguje s kyslíkom, dokonca ani pri 900 ° C, keď sa začne formovať ochranná vrstva ochrany proti Siio2; A potom pri 1400 ° C kremík reaguje so vzduchovým dusíkom za vzniku zmesi nitrhov, bez a ak3N4.
Silikón tiež reaguje pri vysokých teplotách s kovmi za vzniku kovových silácií:
2 mg (s) + áno (s) => mg2Áno (s)
2CU (s) + áno (s) => cu2Áno (s)
Pri teplote miestnosti reaguje výbušné a priamo s halogénmi (neexistuje žiadna vrstva SIO2 to to pred tým chráni). Napríklad máte reakciu na tvorbu SIF4:
Áno (s) + 2f2(g) => sif4g)
A hoci kremík je vo vode nerozpustný, Red Alive reaguje s parným prúdom:
Áno (s) + h2Alebo (g) => Si2(s) + 2h2g)
Elektronická štruktúra a konfigurácia
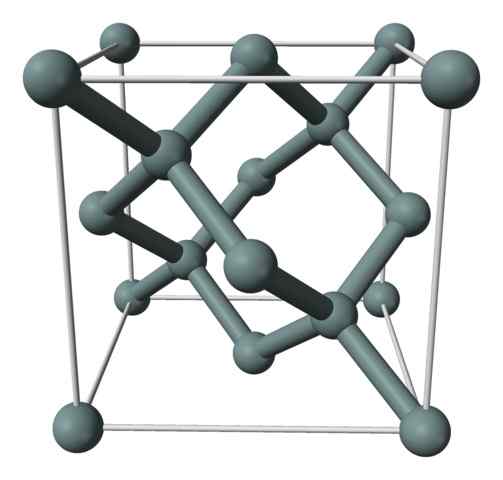 Kryštalická štruktúra alebo jednotná bunka kremíka predstavovaného modelom guľôčok a tyčí. Zdroj: Benjah-Bmm27 [verejná doména]
Kryštalická štruktúra alebo jednotná bunka kremíka predstavovaného modelom guľôčok a tyčí. Zdroj: Benjah-Bmm27 [verejná doména] Horný obrázok zobrazuje kubickú štruktúru vycentrovanú na tvári (FCC), rovnako ako v diamante, pre kremíkový kryštál. Šedé gule zodpovedajú atómom, ak, ako sa ocenilo, sú navzájom kovalentne spojené; Okrem toho majú tetraedrálne prostredie, ktoré sa reprodukujú pozdĺž pohára.
Kryštál kremíka je FCC, pretože atóm sa pozoruje, ak sa nachádza na každej z tvárí kocky (6 × 1/2). Existuje tiež osem atómov, ak vo vrcholoch kocky (8 × 1/8) a vo vnútri sa nachádzajú štyri (tie, ktoré okolo nich ukazujú dobre definovaný tetraedron, 4 × 1).
Uvedené vyššie, každá jednotková bunka má celkom osem atómov kremíka (3 + 1 + 4, čísla uvedené v odseku vyššie); Charakteristika, ktorá pomáha vysvetliť jeho vysokú tvrdosť a tuhosť, pretože čistý kremík je kovalentný kryštál, ako aj diamant.
Kovalentný charakter
Tento kovalentný charakter je spôsobený skutočnosťou, že podobne ako uhlík má kremík štyri valenčné elektróny podľa svojej elektronickej konfigurácie:
[Ne] 3s2 3p2
Na prepojenie sú čisté orbitály 3s a 2p zbytočné. Preto atóm vytvára štyri hybridné orbitály SP3, S ktorými môžete vytvoriť štyri si-si-kovalentné väzby a týmto spôsobom dokončiť oktet Valencia pre dva atómy kremíka.
Kryštál kremíka sa potom vizualizuje ako kovalentná a trojrozmerná sieť zložená z vzájomne prepojenej tetraedry.
Táto sieť však nie je dokonalá, pretože predstavuje defekty a limity zŕn, ktoré oddeľujú a definujú kryštál od iného; A keď sú také kryštály veľmi malé a početné, hovorí sa o polyristalínovej tuhej látke, identifikovanej jeho heterogénnym jasom (podobne ako scammed Mosaic alebo povrchové striebro).
Elektrická vodivosť
SI-IF odkazy s ich dobre umiestnenými elektrónmi v zásade nesúhlasia s tým, čo sa očakáva od kovu: more elektrónov „zvlhčujú“ ich atómy; Aspoň je to tak pri izbovej teplote.
Keď sa však teplota zvyšuje, kremík začne poháňať elektrinu, a preto sa správa ako kov; To znamená, že je to polovodičový metaloidový prvok.
Amorfný kremík
Silikónové tetraheders nie vždy prijímajú štrukturálny vzor, ale môžu byť usporiadané nepokojne; A dokonca s atómami kremíka, ktorých hybridizácia sa zdá byť SP3 ale SP2, čo prispieva k ďalšiemu zvýšeniu stupňa poruchy. Preto sa hovorí o amorfnom a nekryštalickom kremíku.
V amorfnom kremíku sú elektronické voľné pracovné miesta, kde niektoré z ich atómov majú orbitál s elektrónom zmiznutý. Vďaka tomu môže jeho tuhá látka samotná vodík, čím vedie k tvorbe vodíkového amorfného kremíka; to znamená, že má odkazy na Si-.
Môže vám slúžiť: interatomické odkazyTáto časť sa potom dospela k záveru tvrdením, že kremík môže byť prezentovaný v troch typoch tuhých látok (nehovoriac o jeho stupni čistoty): kryštalický, polyristalín a amorfný.
Každý z nich má svoj vlastný spôsob alebo výrobný proces, ako aj jeho aplikácie a dilemu pri rozhodovaní o tom, ktoré z týchto troch má použiť, pozná ich výhody a nevýhody.
Kde je to a získajte
 Kremenné kryštály (oxid kremičitý) sú jedným z hlavných a najvýznamnejších minerálov, kde sa nachádza kremík. Zdroj: James St. John (https: // www.Flickr.com/photos/jsjgeology/22437758830)
Kremenné kryštály (oxid kremičitý) sú jedným z hlavných a najvýznamnejších minerálov, kde sa nachádza kremík. Zdroj: James St. John (https: // www.Flickr.com/photos/jsjgeology/22437758830) Silikón je siedmym najhojnejším prvkom vesmíru a druhý v zemskej kôre, ktorý tiež obohacuje plášť Zeme svojou obrovskou rodinou minerálov. Tento prvok je spojený s mimoriadne dobre s kyslíkom a vytvára širokú škálu oxidov; Medzi nimi, oxid kremičitý, tak2, a kremičitany (rozmanité chemické zloženie).
Oxid kremičitý je videný voľným okom v púštiach a plážach, pretože piesok sa skladá hlavne zo SIO2. Tento oxid sa zase môže prejaviť v niekoľkých polymorfoch, ktorý je najbežnejším: kremeň, ametyst, achát, Christobalit, Tripolis, Coesite, Stišovita a Thundimita. Okrem toho sa nachádza v amorfných tuhých látkach, ako sú opály a diatomea krajiny.
Medzitým sú kremičitany ešte bohatšie štrukturálne a chemicky. Medzi niektoré z minerálov kremičitanov je možné spomenúť: azbest (biela, káva a modro), živce, íly, mycies, olivové, hlinítka, zeolity, amphibe a pyroxénes.
Prakticky sú všetky horniny zložené zo kremíka a kyslíka, so svojimi stabilnými väzbami Si-O a ich kremičitanom a kremičitanom zmiešaným s oxidmi kovov a anorganickými druhmi.
-Redukcia oxidu kremičitého
Problém, ktorý predstavuje získanie kremíka, je prelomiť toto spojenie SI-O, pre ktoré je potrebná špeciálna rúčka a stratégia s dobrou redukciou. Surovina pre tento proces je kremenný oxid kremičitý, ktorý sa pohybuje skôr, až kým nie je jemný prášok.
Z tohto zemného oxidu kremičitého sa môže pripraviť buď amorfným kremíkom alebo polyristalínom.
Amorfný kremík
V malom rozsahu, vyrobený v laboratóriu a s príslušnými opatreniami, sa oxid kremičitý zmiešal s prachom horčíka v topiacich sa hrnci a je spálený v neprítomnosti vzduchu. Potom sa uskutoční ďalšia reakcia:
SIO2(s) + mg (s) => 2mgo (s) + áno (s)
Horčík a oxid sa eliminujú zriedeným roztokom kyseliny chlorovodíkovej. Potom je zostávajúca tuhá látka ošetrená kyselinou fluorhoorovou, takže končí reagovať SIO2 nadmerne; V opačnom prípade nadmerné horčík uprednostňuje tvorbu jeho príslušného Siliciuro, mg2Áno, nežiaduca zlúčenina pre tento proces.
SIO2 Transformuje sa na prchavý plyn SIF4, ktorá sa získava pre inú chemickú syntézu. Nakoniec sa amorfné kremíkové cesto suší pod plynovým vodíkovým prúdom.
Ďalšou podobnou metódou na získanie amorfného kremíka je použitie toho istého SF4 predtým vyrobené alebo SICL4 (predtým získané). Výpary týchto kremíkových halogenurí sa prenášajú cez tekutý sodík v inertnej atmosfére, takže zníženie plynu sa môže podať bez prítomnosti kyslíka:
Sicl4(g) + 4na (l) => áno (s) + 4nacl (l)
Je zaujímavé, že s amorfným kremíkom sa vyrábajú solárne panely s vysokým obsahom energetiky.
Kryštalický kremík
Začínajúc znova od práškového oxidu kremičitého alebo kremeňa, sú odvezené do elektrickej oblúkovej rúry, kde reaguje s koksom. Týmto spôsobom už redukčné činidlo už nie je kovom, ale uhlíkovým materiálom s vysokou čistotou:
SIO2(s) + 2c (s) => áno (s) + 2co (g)
Pri reakcii sa vyrába aj karbid kremíka, SIC, ktorý je neutralizovaný nadbytkom SIO2 (Opäť je kremeň nadmerne):
2SIC (s) + SIO2(s) => 3Si (s) + 2co (g)
Ďalšou metódou na prípravu kryštalického kremíka je použitie hliníka ako redukčného činidla:
3sio2(s) + 4AL (l) => 3si (s) + 2AL2Ani3(S)
A počnúc hexafluórusilikátom draslíka, K2[Sif6], reaguje tiež s kovovým hliníkom alebo draslíkom, aby spôsobil rovnaký produkt:
Klimatizovať2[Sif6] (l) + 4AL (l) => 3Si (s) + 6kf (l) + 4alf3g)
Okamžite sa kremík rozpustí v roztavenom hliníku a keď sa systém ochladzuje, prvá kryštalizuje a oddeľuje od druhej; To znamená, že sú tvorené kryštály kremíka, ktoré vyzerajú šedivo farbami.
Polyristalínový kremík
Na rozdiel od inej syntézy alebo produkcie, aby sa získal polyristalínový kremík, začína salánovou plynnou fázou, Sih4. Tento plyn prechádza pyrolýzou nad 500 ° C, takým spôsobom, že dochádza k tepelnému rozkladu, a tým aj jeho počiatočné výpary, nakoniec ukladajú kremíkové polyristály na polovodičový povrch.
Nasledujúca chemická rovnica ilustruje reakciu, ktorá prebieha:
Áno h4(g) => áno (s) + h2g)
Je zrejmé, že v komore by nemala byť kyslík, pretože by reagoval so SIH4:
Áno h4(g) + 22(g) => Sio2(s) + 2h2O (g)
A spontánnosť spaľovacej reakcie je taká, ktorá sa rýchlo vyskytuje pri teplote miestnosti v tvári.
Ďalšia syntetická cesta na výrobu tohto typu kremíkovej časti kryštalického kremíka ako suroviny. Vďaka tomu reagujú s chloridom vodíka pri teplote okolo 300 ° C, takže sa vytvorí trichlórosilano:
Môže vám slúžiť: železo (prvok): Charakteristiky, chemická štruktúra, použitieÁno (s) + 3HCl (g) => sicl3H (g) + h2g)
A SICL3H reaguje na 1100 ° C na regeneráciu kremíka, ale teraz polyristalín:
4SICL3H (g) => áno (s) + 3Sicl4g) + 2h2g)
Stačí vidieť rovnice, ktoré poskytujú predstavu o práci a prísnych výrobných parametroch, ktoré sa musia brať do úvahy.
Izotopy
Kremík je prirodzene a hlavne ako izotop 28Áno, s množstvom 92,23%.
Okrem toho existujú dva ďalšie izotopy, ktoré sú stabilné, a preto netrpia rádioaktívny rozklad: 29Áno, s množstvom 4,67%; a 30Áno, s množstvom 3,10%. Byť taký hojný 28Áno, nie je prekvapujúce, že atómová hmotnosť kremíka je 28 084 u.
Kremík môže byť tiež v niekoľkých rádioizotope, medzi ktorými 31Áno (tón1/2= 2,62 hodín) a 32Áno (tón1/2= 153 rokov). Iné (22Jo - 44Ak majú tón1/2 Veľmi krátke alebo krátke (menej ako stotiny sekúnd).
Riziká
Čistý kremík je relatívne inertná látka, takže sa obvykle akumuluje v žiadnom orgáne alebo tkanive, pokiaľ je vystavená nízkemu vystaveniu. V prachovej forme môže spôsobiť podráždenie očí, čo spôsobuje slzy alebo začervenanie, zatiaľ čo ich dotyk môže spôsobiť pokožku, svrbenie a odlupovanie.
Ak je expozícia veľmi vysoká, kremík môže poškodiť pľúca; Ale bez následných účinkov, pokiaľ suma nestačí na to, aby spôsobila udusenie. To sa však nestane s kremenným, ktorý je spojený s rakovinou pľúc a chorobami, ako je bronchitída a emfyzém.
Podobne je čistý kremík svojou povahou veľmi zriedkavý a jeho zlúčeniny, ktoré sú bohaté v zemskej kôre, nepredstavujú žiadne riziko pre životné prostredie.
Teraz, pokiaľ ide o orgány, môžu byť toxické; Ale mnohí z nich závisia od toho, na ktorý sa zvažuje, ako aj ďalšie faktory (reaktivita, pH, mechanizmus pôsobenia atď.).
Žiadosti
Stavebný priemysel
Silikónové minerály integrujú „kameň“, s ktorým sú postavené budovy, domy alebo pamiatky. Napríklad cementy, betón, štuky a žiaruvzdorné tehly pozostávajú z pevných zmesí založených na kremičitách. Z tohto prístupu sa dá javiť ako užitočnosť, ktorú má tento prvok v mestách a architektúre.
Sklo a keramika
Z oxidu kremičitého sa môžu vyrábať kryštály používané na optických zariadeniach, či už ako izolátory, bunky pre vzorky spektrofotometrov, piezoelektrické kryštály alebo iba okuliare.
Keď sa materiál pripravuje aj s viacerými prísadami, skončí sa transformáciou na amorfnú tuhú látku, známu ako sklo; a hory piesku sú zvyčajne zdrojom oxidu kremičitého alebo kremeňa potrebného na jeho výrobu. Na druhej strane sa vyrábajú keramické a porcelánové materiály keramiky a porcelánové materiály.
Prepojené nápady, kremík je tiež prítomný v remeslách a ozdobách.
Zliatiny
Silikónové atómy môžu kohézne a byť miešateľné s kovovou matricou, takže je prídavkou pre početné zliatiny alebo kovy; Napríklad oceľ, na výrobu magnetických jadier; bronzy na výrobu telefónnych káblov; a hliník, pri výrobe zliatiny z hliníka-sailio pre ľahké automobilové diely.
Preto sa dá nájsť nielen v „kameni“ budov, ale aj v kovoch svojich stĺpcov.
Zjazdovky
 Želatínové siliky gule, ktoré sa používajú ako sušie. Zdroj: Dikov [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Želatínové siliky gule, ktoré sa používajú ako sušie. Zdroj: Dikov [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Oxid kremičitý vo forme gélu alebo amorfného, umožňuje výrobu tuhých látok, ktoré pôsobia ako sušiek pri chytaní molekúl vody, ktoré vstupujú do nádoby a udržiavajú ich interiérový suchý.
Elektronický priemysel
 Polyristický a amorfný kremík sa používa na výrobu solárnych panelov. Zdroj: pxhere.
Polyristický a amorfný kremík sa používa na výrobu solárnych panelov. Zdroj: pxhere. Silikónové vrstvy rôznych hrúbok a farieb sú súčasťou počítačových čipov, ako aj s ich tuhými (kryštalickými alebo amorfnými), boli navrhnuté integrované obvody a solárne články.
Keďže sú polovodičom, atómy sú začlenené s menším počtom (al, b, ga) alebo viacerým elektrónom (p, as, sb), aby sa transformovali do typových polovodičov p ani n, respektíve. S dvoma odboňmi Silicios, jedna n A druhý p, Vyrábajú sa diódy žiaričov svetla.
Silikónové polyméry
Slávne silikónové lepidlo pozostáva z organického polyméru podporovaného stabilitou reťazcov odkazov SI-O-Si ... Ak sú tieto reťazce veľmi dlhé, krátke alebo zosieťované, vlastnosti zmeny silikónového polyméru, ako aj ich záverečné žiadosti.
Medzi jeho použitia je možné uviesť nasledujúce:
-Lepidlo alebo lepidlá, nielen na spojenie papierov, ale aj stavebné bloky, gumy, sklenené panely, skaly atď.
-Lubrikanty v hydraulických brzdových systémoch
-Posilňuje obrazy a zlepšuje jas a intenzitu ich farieb, súčasne, čo vám umožní odolávať zmenám teploty bez praskania alebo automobilu
-Používajú sa ako spreje na odpudzovanie vody, ktoré zostávajú suché niektoré povrchy alebo predmety
-Dávajú osobné hygienické výrobky (zubné cestoviny, šampón, gély, krémy žiletka atď.) Pocit, že by ste boli hodvábne
-Jeho povlaky chránia elektronické komponenty jemných zariadení pred teplom a vlhkosťou, ako sú mikroprocesory
-S silikónovými polymérmi sa niekoľko gumových guličiek, ktoré sa odrazia, sotva spadli na podlahu.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Kremík. Zdroj: In.Wikipedia.orgán
- Mikrochemikálie. (s.F.). Kryštalografia kremíka. Obnovené z: mikrochemikálií.com
- Šošovica B.Vložka. (2019). Tabuľka doby: kremík. Získané z: Lentech.com
- Marques Miguel. (s.F.). Dochádza k kremíku. Získané z: Nautilus.Fis.Uc.Pt
- Viac hemantný. (5. novembra 2017). Kremík. Získané z: Hemantmore.orgán.v
- Pilgaard Michael. (22. augusta 2018). Kremík: výskyt, izolácia a syntéza. Obnovené z: pilgaardelegs.com
- DR. Doug Stewart. (2019). Fakty kremíka. Chemickolák. Získané z: Chemicool.com
- Christiana Honsberg a Stuart Bowden. (2019). Zbierka zdrojov pre fotovoltaického pedagóga. Pedukácia. Zdroj: Pedukation.orgán
- Americká rada pre chémiu, Inc. (2019). Silikóny v každodennom živote. Získané z: SEHSC.Americký.com

