Základné soli vzorec, vlastnosti, nomenklatúra, príklady

- 4002
- 657
- Tomáš Klapka
Ten základné soli Sú to všetky, ktoré sa rozpúšťajú vo vode, vytvárajú roztoky s hodnotami pH vyšším ako 7. Toto je vysvetlené formovaním OH iónov-, ktoré pochádzajú priamo z procesu rozpúšťania alebo rovnováhy hydrolýzy, na ktorom sa anión zúčastňuje.
Základné soli obsahujú anión oh- V ich pevných látkach. Napríklad alkalické hydroxidy, ako je sodík a draslík, NaOH a KOH, sa považujú za členov týchto solí; Aj keď sú mimoriadne žieravé, a preto si zaslúžia nominálnu hodnotu hydroxidov namiesto toho, aby sa nazývali soli.
 Hydroxid sodný je príkladom základnej soli
Hydroxid sodný je príkladom základnej soli Ostatné základné soli majú namiesto toho anióny ako uhličitan, co32-. Uhličitan sa odvodzuje z kyseliny uhličitého, h2Co3, Slabá kyselina. Preto sa ako základné soli klasifikujú uhličitanové soli, ako napríklad uhličitan vápenatý používaný v antacidách. Rovnaké zdôvodnenie platí pre hydrogenuhličitan sodný, NAHCO3, A pre všetky ostatné solí hydrogenuhličitanu.
Základné soli sú dôležité, pretože niektoré z nich pomáhajú neutralizovať kyslosť potravín. Môžu sa tiež použiť na prípravu tlmenia roztokov na alkalické pH.
[TOC]
Definície
Základné soli majú dve definície, ktoré sa navzájom dopĺňajú: obsahujú OH anióny- Vo svojich tuhých látkach alebo generujte rovnaké hydroxilli anióny, keď sa ich kryštály rozpustia vo vode.
Bez ohľadu na vybranú definíciu, pH jej vodných roztokov bude väčšie ako 7 rokov, a preto budú alkalické alebo základné.
Všeobecný vzorec základných solí
Objasnené to, čo chápe základná soľ, jej vzorec, aj keď nie striktne všeobecný, je nasledujúci:
Mn(Oh)WXovložka
Kde m je kovový alebo amónny katión, OH Hydroxils a XO anión odvodený od slabej alebo silnej kyseliny. Predplatné n, W a vložka Koľko m, oh a xo, tvoria základnú soľ, ako aj ich rozmery.
Poznač si to vložka Môže sa to rovnať nule, čo znamená, že máme alkalický alebo alkalinoterreo hydroxid. To sa stane s Naoh a Koh. Podobne, W Môže to byť nula, čo znamená, že neexistujú žiadne ióny OH-. Napríklad Caco3 Nemá Oh-, A napriek tomu zostáva základnou soľou.
Môže vám slúžiť: sulfid vápenatý (CAS): Štruktúra, vlastnosti, získanie, použitiaZ vyššie uvedeného sa dospelo k záveru, že všeobecný vzorec základných solí je mn(Oh)WXovložka, Ale nie všetky soli dodržiavajú to. Preto je dôležitejším faktorom, ktorý treba zohľadniť. Preto bude známe, keď je soľ základná, bez ohľadu na to, či má ióny, OH- Vo svojich vzorcoch.
Základné vlastnosti soli
Základné soli sa rozpúšťajú vo vode podľa nasledujúcej rovnice:
Mn(Oh)WXovložka(s) → nM+(Ac) + WOh-(Ac) + vložkaXo-(Ac)
Všimnite si, že keď rozpustí uvoľnenie OH ióny- vo vode. To ovplyvňuje pH roztoku a stáva sa alkalickým s hodnotou vyššou ako 7. Napríklad základný dusičnan vápenatý sa rozpúšťa vo vode podľa toho, ako to nasleduje:
CA (oh) nie3(S) → CA2+(Ac) + OH-(ac) + nie3-(Ac)
Hodnoty n, W a vložka Pre túto soľ sa rovná 1.
Na druhej strane, základné soli, ktoré nemajú OH-, Ale anión odvodený od slabej kyseliny sa hydrolyzuje vo vode:
Zlodej3(S) → CA2+(ac) + co32-(Ac)
Co32-(Ac) + h2Alebo (l) ⇌ hCO3-(Ac) + OH-(Ac)
Všimnite si, že produktom tejto hydrolýzy je OH anión-. Odtiaľ leží zásaditosť týchto základov. Avšak, ako sa očakávalo, sú menej základné ako tie, ktoré už majú ióny OH- prítomné v ich kryštáloch. Napríklad NaOH je mimoriadne základný:
NaOH (S) → NA+(Ac) + OH-(Ac)
Uvoľnite OH ióny- Hneď ako sa voda dotkne; Alebo horšie, sotva sa dotýka vlhkosti pokožky.
Môže vám slúžiť: Karbocation: Tvorba, charakteristiky, typy, stabilitaIné fyzikálne alebo chemické vlastnosti základných solí sa príliš nelíšia od vlastností iných neutrálnych alebo kyslých solí.
Menovanie
Nomenklatúra základných solí závisí od povahy aniónu XO: Ak je monoatomická, alebo ak je to oxoanion. Táto časť sa však zameriava najmä na základné solí s aniónmi OH-. Tí, ktorí ich nemajú, majú oveľa ľahšie nomenklatúry na zapamätanie si alebo rozum.
S monoatomickými aniónmi
Monoatomické anióny nie sú reprezentované ako XO, ale ako x. Odvodzujú z hydraceidu HX, ako je kyselina fluoridová, HF alebo kyselina chlorovodíková, HCI atď.
V týchto prípadoch sú systematicky pomenované dvoma spôsobmi:
(Číselná predpona s výnimkou opice) Hydroxi + aniónový názov končiaci príponou -uro + názov kovu s valenciou v zátvorkách (ak má viac ako jeden)
Napríklad soľ Ni (OH) Cl sa nazýva nikel hydroxychlorid (II).
Názov aniónu s ukončením -uro + -(číselná predpona s výnimkou opice) Hydroxid + názov kovu a jeho valencia v zátvorkách
Napríklad soľ Ni (OH) Cl môže byť tiež pomenovaný ako nikel-chlorid-hydroxid (II).
Máme tiež tradičnú nomenklatúru, niekedy zmiešanú so systematickým:
Názov aniónu, po ktorom nasleduje (číselná predpona okrem opice) Základné a názov kovu s príponami -ooso alebo -ico, ako je použité.
Napríklad Ni (OH) CL sa nazýva nikel základný chlorid alebo základný chlorid niklu (II).
S oxoanónmi
Systematická nomenklatúra pre základné soli, ktoré majú oxoanióny, je o niečo komplikovanejšia. Najjednoduchšia verzia je však zostavená nasledovne:
(Číselná predpona) Hydroxid- (názov aniónu) + názvu kovu a jeho Valencia v zátvorkách
Napríklad viera (oh) nie3 sa volá: dusičnan hydroxid-železo (II).
Má tiež tradičnú nomenklatúru:
Základné NION + (číselná predpona) Názov + kovový názov končiaci v -oso alebo -ico
Môže vám slúžiť: kyslík: vlastnosti, štruktúra, riziká, použitieTeda viera (oh) nie3 Volá sa: Železný základný dusičnan alebo základný dusičnan železa (II).
Výcvik
Základné soli sú produktom neutralizácií kyseliny, konkrétne medzi hydratom alebo oxoacidou s nadbytkom bázy alebo hydroxidu:
Báza (prebytok) + kyselina → Základná soľ alebo alkalická + voda
Napríklad CA (OH) nie3 Vytvára sa neutralizáciou kyseliny dusičnej s nadbytkom hydroxidu vápenatého:
CA (OH)2(Prebytok) + hno3 → CA (OH) č3 + H2Ani
Ďalšia formácia odbornej prípravy by bola nasledovná:
Viera (oh)3(Prebytok) + h2SW4 → fe (oh) SO4 + 2h2Ani
Táto soľ sa nazýva: základný sulfát železa, základný sulfát železa (III) alebo železo-hydroxid-sulfát (III).
Príklady základných solí
 Antacidy, ako napríklad uhličitan vápenatý, CACO3, sú príkladmi základných solí. Zdroj: Pixabay.
Antacidy, ako napríklad uhličitan vápenatý, CACO3, sú príkladmi základných solí. Zdroj: Pixabay. Nakoniec budú uvedené niektoré ďalšie príklady základných solí spolu s ich jednoduchšími názvami:
-Nach3COO: octat sodný
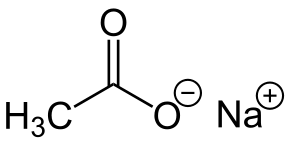 Octan sodný
Octan sodný -Nat2S: Sulfid sodný
 Sulfid sodný
Sulfid sodný -KCN: Kyanid draselný
-Mgco3: uhličitan horčík
-Viera (oh) tak3: Základný sulfit železa (III)
-Viera (oh) (c6H5Coo)2: Základný železný benzoát (III)
-AUCL (OH)2: Zlato Dibasic chlorid (III)
-Cuclo3(OH): Základný chloretný meď (II)
-Na (oh) tak4: Základný síran hliník
-Pb (OH)2Co3: Dibasic olovo uhličitan (IV)
Problém základných solí spočíva v tom, že nie všetky z nich sa dajú pripraviť, pretože prebytok základne alebo hydroxidu nestačí na ich kryštalizáciu bez toho, aby sa uchýlili k iným procesom. To je prípad PB (OH)2Co3. Tento uhličitan však existuje ako biely olovo (ii) pigment, ktorého vzorec je 2pbco3· Pb (OH)2 alebo PB3(Oh)2(CO3)2.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Alkalická soľ. Zdroj: In.Wikipedia.orgán
- Wu c., Kladka. & Hooper n. (1. júla 2014). Vlastnosti solí kyselinou. Získané z: Chem.Librettexts.orgán
- Nicola McDougal. (2020). Kyslé a základné roztoky soľných solí: Vysvetlenie a príklad. Štúdium. Získané z: štúdie.com
- Problém a chemické cvičenia. (s.F.). Základné soli. Získané z: Accorral.je
- « Koncepcia a príklady materiálová štruktúra
- Vlastnosti funkcie rozloženej funkcie, príklady, cvičenia »

