Chimotripsínové charakteristiky, štruktúra, funkcie, mechanizmus pôsobenia
- 2084
- 494
- Valentín Dula
Ten chimotrips Je to druhý najhojnejší tráviaci proteín pankreasu smerom k tenkému čreve. Je to enzým patriaci do rodiny serín-proteázy a špecializuje sa na hydrolýzu peptidových väzieb medzi aminokyselinami, ako je tyrozín, fenylalanín, tryptofán, metóda a leukín prítomný vo veľkom proteíne.
Názov „Chemotripsin“ spája, vlastne skupina enzýmov, ktoré sú produkované pankreasom a ktoré sa aktívne podieľajú na črevnom trávení proteínov u zvierat. Slovo odvodzuje z akcie renínu, ktorú má tento enzým na obsah žalúdka alebo „chimo“.
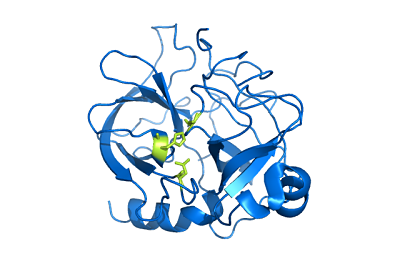
 Štruktúra chimotripsínu (Zdroj: používateľ: Mattyjenjen [Attribution] prostredníctvom Wikimedia Commons)
Štruktúra chimotripsínu (Zdroj: používateľ: Mattyjenjen [Attribution] prostredníctvom Wikimedia Commons) Aj keď nie je presne známe, aké široké je jeho distribúcia v živočíšnej kráľovstve, predpokladá sa, že tieto enzýmy sú prítomné aspoň u všetkých jahniat a existujú správy o ich prítomnosti v „primitívnejších okrajoch“, ako sú článkonožce a Celestroads.
U zvierat, ktoré majú pankreas, je takýto orgán hlavným miestom výroby chimotripsínu, ako aj ďalšie proteázy, enzymatické inhibítory a prekurzory alebo zimogény.
Chimotripy sú najviac študované a lepšie charakterizované enzýmy, a to nielen vo vzťahu k ich biosyntéze, ale aj s ich aktiváciou z zimogénu, jeho enzymatických vlastností, jeho inhibíciou, jej kinetickými a katalytickými vlastnosťami a jeho všeobecnou štruktúrou.
[TOC]
Vlastnosti
Chimotripy sú endopeptidázy, to znamená, že sú to proteázy, ktoré hydrolyzujú peptidové väzby aminokyselín v „vnútorných“ polohách iných proteínov; Aj keď sa tiež ukázalo, že môžu hydrolyzovať estery, Amidas a Arilamidas, aj keď s menšou selektivitou.
Majú priemernú molekulovú hmotnosť asi 25 kDa (245 aminokyselín) a sú produkované z prekurzorov, ktoré sú známe ako chemotripsinogény.
Z pankreasu hovädzích zvierat boli očistené 2 typy chemotripsinogénov, A a B. V modeli ošípaných bol opísaný tretí chemotripinogén, Chimotripsinogén C bol opísaný. Každý z týchto troch zimogénov je zodpovedný za výrobu chimotropsínov A, B a C, respektíve.
Môže vám slúžiť: Quintana Roo Flora a faunaChimotripsin A je tvorený tromi reťazcami polypeptidov, ktoré sú navzájom kovalentne spojené cez mosty alebo disulfidové väzby medzi zvyškami cysteínu. Je však dôležité spomenúť, že mnohí autori to považujú za monomérny enzým (zložený z jednej podjednotky).
Tieto reťazce tvoria štruktúru, ktorá má elipsoidový tvar, v ktorom sú skupiny, ktoré majú elektromagnetické zaťaženie, umiestnené smerom k povrchu (s výnimkou aminokyselín, ktoré sa zúčastňujú na katalytických funkciách).
Všeobecne sú chimotropsíny mimoriadne aktívne na kyslé pH, hoci tie, ktoré boli opísané a čistené z hmyzu a iných nevertebrate zvierat, sú stabilné pri pH medzi 8 a 11 a extrémne nestabilným na zníženie pH.
Funkcie chemotripsínu
Keď je stimulovaná exokrinná pankreas, či už pomocou hormónov alebo elektrickými impulzmi, tento orgán uvoľňuje sekrečné granule bohaté na chemotripinogén, ktorý kedysi dosiahne tenké črevo, je rezaný inou proteázou medzi odpadom 15 a 16 a potom je „automaticky stíhaný“ na vykonanie úplne aktívny proteín.
Asi hlavnou funkciou tohto enzýmu je konať v zhode s ostatnými vylučovanými proteázami smerom k gastrointestinálnemu systému na trávenie alebo degradáciu bielkovín konzumovaných potravinami.
Produkty takejto proteolýzy následne slúžia ako zdroj uhlíka a energie prostredníctvom katabolizmu aminokyselín alebo sa dajú „recyklovať“ priamo na tvorbu nových bunkových proteínov, ktoré budú mať na fyziologickej úrovni viac a rozmanitých funkcií.
Mechanizmus akcie
Chimotripsins vyvíjajú svoje účinky až po aktivácii, pretože sa vyrábajú ako „prekurzor“ (zimogén), ktoré sa nazývajú chemotropsinogénne.
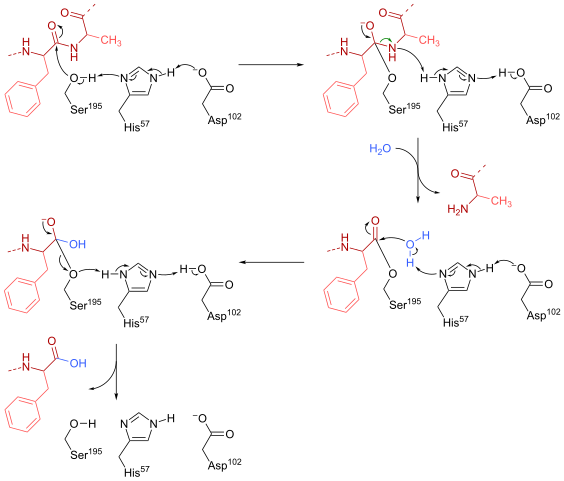 Mechanizmus reakcie Quimotripsin (zdroj: HBF878 [CC0] cez Wikimedia Commons)
Mechanizmus reakcie Quimotripsin (zdroj: HBF878 [CC0] cez Wikimedia Commons) Výcvik
Zimogény chimotripsínu sú syntetizované acinárnymi bunkami pankreasu, po ktorých migrujú z endoplazmatického retikula do Golgiho komplex.
Môže vám slúžiť: Vedenia, ktoré súvisia s biológiouTieto granule sa hromadia na koncoch acinos a uvoľňujú sa v reakcii na hormonálne stimuly alebo nervové impulzy.
Aktivácia
V závislosti od aktivačných podmienok je možné nájsť niekoľko typov chimotripsínov, avšak všetky naznačujú proteolytický „rez“ peptidového spojenia v zimogéne, chimotripsinogen, proces katalyzovaný enzýmovým tripsínom.
Aktivačná reakcia spočiatku pozostáva z reznej väzby medzi aminokyselinami 15 a 16 chimotripsinogénu, ktorý tvorí π-Quimotripsin, schopný „samohodnota“ a dokončiť aktiváciu autotalýzy.
Pôsobenie tohto posledného enzýmu podporuje tvorbu po peptidoch spolu pomocou C-terminálneho reťazca, ktorý začína zvyškom 149).
Časti zodpovedajúce odpadu 14-15 a 147-148 (dva dipéptidy) nemajú žiadne katalytické funkcie a oddeľujú sa od hlavnej štruktúry.
Katalytická aktivita
Chimotripsín je zodpovedný za hydrolyzovacie peptidové väzby, ktoré prevažne útočia na karboxylovú časť aminokyselín, ktoré majú aromatické bočné skupiny, tj aminokyseliny, ako je tyrozín, tryptofán a fenylalanín.
Serín (je 195) v aktívnom mieste (séria Gly-Asp-Gly-Glu-Ala-Val) tohto typu enzýmov je pravdepodobne najdôležitejším zvyškom jeho prevádzky. Reakčný mechanizmus je nasledujúci:
- Chimotripsín sa spočiatku nachádza vo forme „substrátu bez“, kde katalytická „triáda“ pozostáva z laterálnej karboxylovej skupiny aspartátového zvyšku (102), imidazolového kruhu histidínového zvyšku (57) a skupinovej strany hydroxylu z hydroxylu skupiny a skupiny. serín (195).
- Substrát sa stretáva s enzýmom a spája sa s tým, aby vytvoril typický reverzibilný komplex enzým-substrát (podľa Micaelijského modelu), kde katalytická „triáda“ uľahčuje nukleofilný útok aktiváciou hydroxylovej skupiny serínu serínu serínu serínu.
Môže vám slúžiť: Dusíkové bázy: Čo sú, klasifikácia, funkcie- Kľúčový bod reakčného mechanizmu spočíva v tvorbe čiastočného spojenia, ktoré vedie k polarizácii hydroxylovej skupiny, ktorá je dostatočná na urýchlenie reakcie.
- Po nukleofilnom útoku sa karboxylová skupina stáva sprostredkovateľom tetraedrálneho oxianionu, ktorý je stabilizovaný dvoma vodíkovými mostíkmi tvorenými skupinami N a H zvyšku Gly 193 a 195.
- Oxyanion je spontánne „usporiadanie“ a vytvára sa enzymatický sprostredkovateľ, do ktorého bola pridaná acylová skupina (acyled enzým).
- Reakcia pokračuje vstupom molekuly vody do aktívneho miesta, molekuly, ktorá podporuje nový nukleofilný útok, ktorý vedie k tvorbe druhého tetraedrálneho sprostredkovateľa, ktorý je tiež stabilizovaný vodíkovými mostíkmi.
- Reakcia končí, keď je tento druhý sprostredkovateľ znova usporiadaný a znovu tvorí enzým-substrátový komplex, kde aktívne miesto enzýmu je obsadené produktom obsiahnutým v karboxylovej skupine.
Odkazy
- Appel, w. (1986). Chymotrypsín: molekulárne a katalytické vlastnosti. Clinical Biochemistry, 19 (6), 317-322.
- Bender, m. L., Killheffer, J. Vložka., & Cohen, s. (1973). Chymotrypsín. CRC Critical Reviews in Biochemistry, 1 (2), 149-199.
- Vyfúknuť d. M. (1971). 6 Štruktúra chymotrypsínu. V enzýmoch (zv. 3, pp. 185-212). Akademická tlač.
- Vyfúknuť d. M. (1976). Štruktúra a mechanizmus chymotrypsínu. Účty chemického výskumu, 9 (4), 145-152.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.
- Polgár, L. (2013). Katalytické mechanizmy serínových a treonínových peptidov. V príručke proteolytických enzýmov (str. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Hypotéza mechanizmu pôsobenia chymotrypsínu. Zborník Národnej akadémie vied Spojených štátov amerických, 43 (11), 969.
- « Syntéza, transpozícia a použitie kyseliny benzylovej
- Charakteristiky vizuálneho vzdelávania, stratégie, činnosti, príklady »

