Zrážať sa

- 1578
- 280
- Adrián Fajnor
Vysvetlíme, čo je zrazenina, zrážacia reakcia, typy, ktoré existujú a uvádzame niekoľko príkladov
 Tvorba žltej zrazeniny pri miešaní roztoku s precipitačným činidlom
Tvorba žltej zrazeniny pri miešaní roztoku s precipitačným činidlom Čo je zrazenina?
A zrážať sa Je to tuhá látka, ktorá sa tvorí z roztoku, buď kryštalizáciou rozpustenej látky, alebo tvorbou nerozpustnej látky pomocou chemickej reakcie.
Prvý prípad sa vyskytuje, keď sa pevná látka, ktorá bola spočiatku rozpustená v rozpúšťadle, ako je voda, sa stane menej rozpustným. Môže sa to stať, keď:
- Teplota roztoku je znížená.
- Pridá sa zrážajúce činidlo.
- Pridá sa ďalšie rozpúšťadlo, v ktorom je tuhá látka menej rozpustná.
Keď sa jeho rozpustnosť stane menšou ako jeho koncentrácia, roztok sa stane presýtený a dochádza k zrážkovej reakcii.
Druhý prípad sa vyskytuje po akejkoľvek chemickej reakcii, ktorá vytvára nerozpustný alebo veľmi malý rozpustný produkt v rozpúšťadle. Akonáhle sa tento produkt začne vytvárať, roztok je rýchlo nasýtený a tuhá látka sa začína zrážať.
Chemická zrážacia reakcia
Zrážacia reakcia je chemický proces, ktorý vedie k tvorbe zrazeniny. V závislosti od toho, ako sa vytvorí zrazenina, je možné reakciu napísať dvoma rôznymi spôsobmi:
- Ak dôjde k zrážaniu, pretože rozpustnosť tuhej látky v rozpúšťadle bola znížená (napríklad chladenie alebo pridanie iného rozpúšťadla), potom zrážacia reakcia zahŕňa iba rozpustenú látku a vyzerala by:

Napríklad, Ak sa octanu sodný rozpustí (ch-3Vrecko) v horúcej vode a potom sa choď ochladí, octanu sodný sa zráža podľa nasledujúcej rovnice:

- Ak dôjde k zrážaniu, pretože sa pridal zrážacie činidlo, potom zrážková reakcia bude zahŕňať rozpustenú látku aj precipitačné činidlo.
Napríklad, Strieborné ióny (AG+) Môžu zrážať z roztoku dusičnanu striebra (Agno3) Pridanie roztoku chloridu sodného alebo NaCl (zrážacie činidlo). Zrážacia reakcia v tomto prípade je daná:
Môže vám slúžiť: nikel chlorid (NICL2): Štruktúra, vlastnosti, získanie, použitia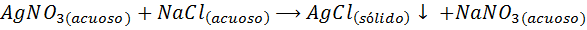
Mechanizmus zrážok
Bez ohľadu na reakciu zrážania sa tvorba zrazeniny vždy vyskytuje v dvoch štádiách nazývaných nukleacia a rast:
-
Nukleácia
Na začiatku zrážkovej reakcie sa tvoria malé častice zrazeniny, ktoré sa nazývajú jadrá, takže táto fáza sa nazýva nukleacia.
-
Rast
Po nukleácii sa už nevytvárajú nové častice, ale už sa vytvorené jadrá začnú rásť, až kým nezastaví zrážky.
Typy zrazeniny
Rýchlosť, s akou sa tvoria precipitáty, ovplyvňuje veľkosť tuhých častíc a ich vlastnosti. V závislosti od veľkosti častíc a povahy zlúčeniny, ktorá sa vyzráža, je možné rozlíšiť tri typy zrazenín:
Kryštalické precipitáty
Je to najjednoduchší typ zrazeniny. V tomto prípade je zrazenina vyrobená z veľkých tuhých častíc s priemerom vyšším ako 0,1 mikrometrov.
 Kryštalická zrazenina pentahydrátu sulfátu medi (II)
Kryštalická zrazenina pentahydrátu sulfátu medi (II) Kryštalické zrazeniny sa tvoria, keď sa zrážacia reakcia vyskytuje pomaly. To umožňuje počas nukleácie tvoriť niekoľko tuhých častíc a každá z týchto častíc má dostatok času na pestovanie a tvorbu veľkých a ťažkých kryštálov, ktoré spadajú na spodok roztoku.
Tieto častice sú takmer vždy kryštalické tuhé látky s plochými a jasnými tvárami, podobne ako fazety diamantu a takmer vždy sa dajú rozlíšiť voľným okom.
Zrazené precipitáty
Sú vyzrážané pre oveľa menšie častice, medzi 0,01 a 0,1 mikrometrov s priemerom. Tento typ zrazeniny sa tvorí, keď dôjde k zrážkovej reakcii veľmi rýchlo, pričom počas nukleácie vytvára veľa častíc, ktoré nemajú čas na pestovanie.
Kvôli svojej veľkosti sú tieto častice veľmi ľahké a sú suspendované v roztoku a tvoria stabilný koloid. Z tohto dôvodu sa neusadzujú na spodnej časti roztoku a vyzerá to zamračené namiesto priehľadnosti.
Môže vám slúžiť: dihydroxyacetón: štruktúra, vlastnosti, získanie, použitia Tri kazeosy rôznych farieb. Tri riešenia sú po vytvorení precipitátov kalné
Tri kazeosy rôznych farieb. Tri riešenia sú po vytvorení precipitátov kalné Okrem toho sú častice také malé, že sa im podarí prekročiť väčšinu filtrov, ktoré sa používajú na oddelenie zrazenín od riešení.
Želé Hacords
Keď sú častice ešte menšie ako častice prípadných zrazenín, tj s priemermi menšími ako 0,01 mikrometrov, precipitáty sa nazývajú želé. Dôvod je ten, že pevná látka získava vzhľad podobný želatíne alebo džemu.
Tieto zrazeniny sa tiež považujú za koloidy. V skutočnosti je želatína typickým príkladom koloidu a tieto precipitáty berú svoje meno z toho istého.
Charakteristické príklady želéznej zrážky sú hydratované oxidy niektorých kovov. Tieto oxidy absorbujú veľké množstvo vody na svojom povrchu, čo jej bráni tvoriť väčšie častice, ktoré kryštalizujú.
Zrážanie príkladov
Octat sodný (CH3Vrecko)
Ako je uvedené vyššie, oct. Ak sa nechá ochladiť pomaly, vytvorí sa kryštalická zrazenina, v ktorej sa pozorujú dlhé biele kryštály ihly.
Sulfid kadmia (II) (CDS)
Sulfid kadmia je veľmi nerozpustná soľ, ktorá sa okamžite premieša v roztoku iónov kadmia (II) s iným, ktorý obsahuje sulfidové ióny.
Pentahydrát z medi (II) (CUO4.5H2Buď)
Pri jeho rozpustení vo vode tvoria hydratované ióny intenzívnej modrej meď. Ak sa voda pomaly odparuje, vyzrážajte krásne modré kryštály Cuso4.5H2Ani. Tieto kryštály sa zdajú byť drahé kamene.
Strieborný bromid (AGBR)
Toto je príklad zlúčeniny, ktorá vyzráža veľmi rýchle vytváranie zrazeniny s veľmi tenkými časticami, ktoré je ťažké filtrovať.
Môže vám slúžiť: rovnocenná váhaHliníkový hydratovaný oxid (III) (do2Ani3.NH2Buď)
Toto je klasický príklad tvorby želatínovej zrazeniny. Sa tvorí, keď roztok hliníka dusičnanu (nie (nie3)3).
Mangánový sulfid (II) (MNS)
Mnoho sulfidov je nerozpustné vo vode a sulfid mangánu nie je výnimkou. To sa vyzráža vo forme veľmi jemného prachu.
Chlorid strieborného (AGCL)
Ióny striebra (i) tvoria veľmi malé rozpustné soli so všetkými halogénmi. Prípad chloridu striebra je klasickým príkladom vyzrážanej formácie v laboratóriu.
Uhličitan vápenatý (Caco3)
Vápnik je jedným z iónov zodpovedných za tvrdosť vody. Keď sa zahrieva voda, ktorá obsahuje vápnik, reaguje na tvorbu uhličitanu vápenatého, ktorý sa vyzráža vo forme bielej vrstvy nazývanej tatár, ktorá je dokonca schopná prekážať potrubia.
Železo Hydratovaný oxid (III) (viera2Ani3.NH2Buď)
Toto je ďalší príklad želatínovej zrazeniny, ktorá je tvorená reakciou roztoku obsahujúceho železné ióny (III) s sodným alebo hydroxidom draselným.
Hydroxid horečnatý (mg (OH)2)
Horčík je ďalšou katiónou zodpovednou za tvrdosť vody, pretože môže zrážať vo forme hydroxidu horčíka v potrubiach a iných systémoch vykurovania vody.
Odkazy
- Bancoft, w. D. (1918). Obrys koloidnej chémie.-Iii. Journal of Franklin Institute, 185(3), 373-387. https: // doi.org/10.1016/S0016-0032 (18) 90710-6
- Civan, f. (2007). Rast kryštálov a tvorba mierky v poréznych médiách. Poškodenie tvorby nádrže, 235-255. https: // doi.org/10.1016/B978-075067738-7/50010-5
- Skoog, D. Do., West, D. M., Holler, f. J., & Crouch, s. R. (2013). Základy analytickej chémie. New York, New York: Cengage Learning.
- Prispievatelia Wikipedia. (2021, 10. januára). Zrážky (chémia). Získaný z.Wikipedia.orgán

