Permanganát draselného (KMNO4)

- 2480
- 744
- Ing. Ervín Petruška
 Permanganát draslíka Permanganátové kryštály
Permanganát draslíka Permanganátové kryštály Čo je draslík permanganát?
On manganistan draselný (Kmno4) Je to anorganická zlúčenina tvorená mangánskym pretransičným kovom zo skupiny 7 (VIIB) -, kyslík a draslík. Je to tmavo fialová sklovitá pevná látka. Jeho vodné roztoky sú tiež tmavo fialové; Tieto roztoky sa stávajú menej fialovou.
Komerčne sa dosahuje v prezentáciách tabliet, kryštálov a prachu. Je známy s názvami kondenzačných alebo minerálnych camaleónov. Termín „chameleón“ naráža na schopnosť minerálu: Ak zmení farbu v kontakte s hydrogénnou sódou a organickými látkami, vyskytuje sa cukor cukor.
KMNO4 Začína trpieť redukciami (získavať elektróny) v slede farieb v nasledujúcom poradí: Purple> modrá> zelená> žltá> bezfarebná (s hnedou hnedou MNO2). Táto reakcia demonštruje dôležitú vlastnosť permanganánu draslíka: je to veľmi silné oxidačné činidlo.
Vzorec
Jeho chemický vzorec je kmno4; to znamená pre každú katión K+ Existuje anión MNO4- Interakcia s tým
Chemická štruktúra draslíka permanganátu
 Kryštalická štruktúra KMNO4
Kryštalická štruktúra KMNO4 Na hornom obrázku je reprezentovaná kryštalická štruktúra KMNO4, čo je orhorrombický typ. Fialové gule zodpovedajú K katiónom+, Zatiaľ čo tetraedron tvorený štyrmi červenými guľami a modro4-.
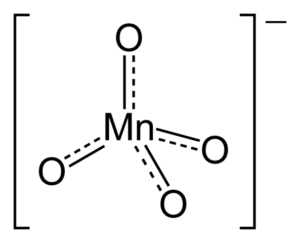
Prečo má anión tetraedrálnu geometriu? Jeho Lewisova štruktúra odpovedá na túto otázku. Bodkované čiary znamenajú, že dvojité spojenia rezonujú medzi Mn a O. Na prijatie tejto štruktúry musí mať kovové centrum hybridizáciu spona3.

Keďže mangánovi chýba neobvyklé páry elektrónov, väzby MN-O nie sú tlačené smerom k rovnakému lietadlu. Podobne je záporné zaťaženie distribuované medzi štyrmi atómami kyslíka, ktoré sú zodpovedné za orientáciu K katiónov+ V rámci kryštalických usporiadaní.
Môže vám slúžiť: ionizačná konštantaKMNO používa4
Medicína a veterinárny
Vďaka svojmu baktericídnemu pôsobeniu sa používa pri mnohých chorobách a stavoch, ktoré spôsobujú kožné lézie, ako napríklad: infekcie nôh húb, impetigo, povrchové rany, dermatitída a tropické vredy.
Vďaka svojmu škodlivému pôsobeniu sa musí draslík permanganát použiť pri nízkych koncentráciách (1: 10000), čo obmedzuje účinnosť jeho konania.
Používa sa tiež pri liečbe parazitózy rýb v akváriách, ktoré produkujú infekcie kožných vnútorností a vredov.
Úprava vody
Je to chemická regenerácia, ktorá sa používa na odstránenie železa, horčíka a sulfidu vodíka z vody (nepríjemného vône), čo je schopné použiť na čistenie odpadovej vody.
Zráža sa železo a horčík vo forme nerozpustných oxidov vody. Okrem toho pomáha odstraňovať hrdzu prítomnú v potrubiach.
Uchovávanie ovocia
Permanganát draslíka odstraňuje etylén generovaný v banánoch počas skladovania, čo mu umožňuje zostať dlhšie ako 4 týždne bez dozrievania, a to aj pri izbovej teplote.
V Afrike ju používajú na namočenie zeleniny s účelom neutralizácie a odstránenia akéhokoľvek súčasného bakteriálneho činidla.
Protipožiarna akcia
Permanganát draslíka sa používa na obmedzenie predĺženia požiaru. Na základe schopnosti permanganátu spustiť oheň, používa sa na vytváranie kontrastál v lesných požiaroch.
Redoxný názov
V analytickej chémii sa jeho štandardizované vodné roztoky používajú ako oxidačný názov v redoxných stanoveniach.
Organické činidlo
Slúži na premenu alkénov na dioly; to znamená, že do dvojitej väzby C = C sa pridávajú dve skupiny OH. Nasledujúca chemická rovnica:

Tiež v roztoku kyseliny sírovej s kyselinou chromovou (H2Croch4) Sa používa na oxidáciu primárnych alkoholov (R-OH) na karboxylové kyseliny (R-COOH alebo RCO2H).
Môže vám slúžiť: ne -polárne kovalentné putoJeho oxidačná sila je dostatočne silná na to, aby oxidovala primárne alebo sekundárne alkylové skupiny aromatických zlúčenín „ich karboxyling“; to znamená, že transformácia bočného reťazca R (napríklad CHO3) V skupine COOH.
Historické použitie
Bola súčasťou práškov používaných ako blesk vo fotografii alebo na začatie termitovej reakcie.
Bol použitý v druhej svetovej vojne na kamufláž bielych koní počas dňa. Na tento účel používali oxid mangánu (MNO2), čo je hnedé; Týmto spôsobom zostali bez povšimnutia.
Syntéza KMNO4
Pyrolusitský minerál obsahuje oxid mangánu (MNO2) a uhličitan draselný (Caco3).
V roku 1659 chemik Johann R. Glauber roztavil minerál a rozpustil ho vo vode a pozoroval vzhľad zeleného sfarbenia v roztoku, ktorý sa neskôr zmenil vo fialovej farbe a nakoniec na červenú farbu. Táto posledná farba zodpovedala generovanej draslíkovej permanganate.
V polovici storočia Henry Condy hľadal antiseptický produkt a spočiatku liečil pyrolusit NaOH a neskôr s KOH, ktorý produkoval tzv. Condy kryštály; to znamená, že draslík permanganát.
Permanganát draslíka sa vyrába priemyselne z oxidu mangánu prítomného v pyrolusitskom mineráli. MNO2 prítomný v mineráli reaguje s hydroxidom draselný a následne sa zahrieva v prítomnosti kyslíka.
2 Mno2 + 4 koh +alebo2 => 2 K2Nadnášať4 + 2 h2Ani
Manganát draselného (K2Nadnášať4) sa premieňa na permanganát draslíka elektrolytickou oxidáciou na alkalické médium.
2 k2Nadnášať4 + 2 h2O => 2 kmno4 + 2 koh +h2
V ďalšej reakcii na produkciu permanganátu draslíka sa manganát draselného reaguje s CO2, Zrýchlenie procesu disproporcie:
3 k2Nadnášať4 + 2 co2 => 2 kmno4 + Nadnášať2 + Klimatizovať2Co3
Môže vám slúžiť: molekulárna orbitálna teóriaKvôli generovaniu MNO2 (oxid mangánu) Proces je nepriaznivý, KOH sa musí generovať z K2Co3.
Vlastnosti KMNO4
Je to fialová kryštalická tuhá látka, ktorá sa topí pri 240 ° C, ktorá má hustotu 2,7 g/ml a molekulovú hmotnosť približne 158 g/mol.
Nie je príliš rozpustný vo vode (6,4 g/100 ml pri 20 ° C), čo naznačuje, že molekuly vody do značnej miery neriešia ióny MNO4-, Pretože možno ich tetraedrálne geometrie vyžadujú pre ich rozpustenie veľa vody. Podobne sa môže rozpustiť aj v metylalkoholu, acetóne, kyseline octovej a pyridínu.
Rozklad
Rozkladá sa pri 240 ° C, uvoľňuje kyslík:
2 kmno4 => K2Nadnášať4 + Nadnášať2 + Ani2
Rozklad môžete zažiť pôsobením alkoholu a iných organických rozpúšťadiel, ako aj pôsobením silných kyselín a redukčných látok.
Oxidačná sila
V tejto soli mangán vykazuje najväčší stav oxidácie (+7) alebo čo je rovnaké, s maximálnym množstvom elektrónov, ktoré môže stratiť iónovým spôsobom. Elektronická konfigurácia mangánu je naopak 3d54siež2; Preto je v draselnom permanganáte celá vrstva Valencie atómu mangánu „prázdna“.
Potom atóm mangánu predstavuje prirodzenú tendenciu získať elektróny; to znamená, že sa má redukovať na iné oxidačné stavy v alkalickom alebo kyslom médiu. Toto je vysvetlenie, prečo KMNO4 Je to silné oxidačné činidlo.
Odkazy
- F.Albert Cotton a Geoffrey Wilkinson, FRS. (1980). Pokročilá anorganická chémia. Editorial Limusa, Mexiko, 2. vydanie, strana 437-452.
- Robin Wasserman. Lekárske použitie pre draslík permanganát. Livestrong sa zotavil.com
- Clark D. 3 Ultimate používa draslík permanganát. Obnovené z technológie.orgán
- J.M. Cedardea, C. Arnáiz a e. Díaz. Draselný permanganát: silný a všestranný oxidant. dlh. Chemické a environmentálne inžinierstvo. University School of Seville.

