Difenylamín
- 5068
- 1312
- MUDr. Žigmund Boška
Čo je defilamín?
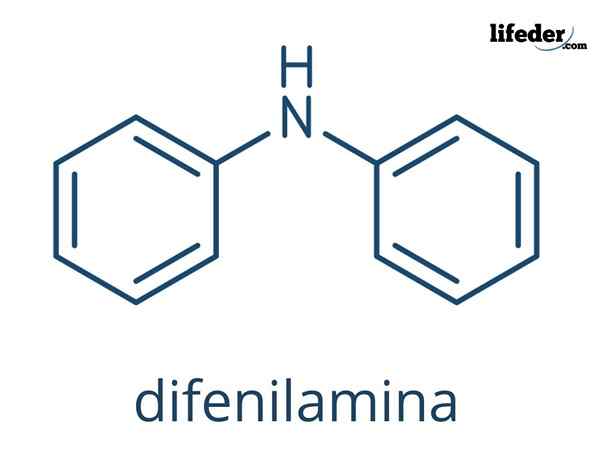
Ten Difenylamín Je to organická zlúčenina, ktorej chemický vzorec je (c6H5)2NH. Jeho názov naznačuje, že ide o amín, ako aj jeho vzorec (-nh2). Na druhej strane sa výraz „difenil“ týka prítomnosti dvoch aromatických krúžkov spojených s dusíkom. Preto je defilamín aromatický amín.
Vo svete organických zlúčenín nie je aromatické slovo nevyhnutne spojené s existenciou jeho vône, ale s charakteristikami, ktoré definujú ich chemické správanie proti určitým druhom.

V prípade difenylamínu, jeho aromaticita a skutočnosť, že ich pevná látka predstavuje výraznú arómu. Nadácia alebo mechanizmy, ktoré riadia jeho chemické reakcie, sa však dajú vysvetliť jeho aromatickým charakterom, ale nie kvôli svojej príjemnej aróme.
Jeho chemická štruktúra, zásadnosť, aromaticita a intermolekulárne interakcie sú premenné zodpovedné za jej vlastnosti: od farby jeho kryštálov po jeho použiteľnosť ako antioxidačné činidlo.
Chemická štruktúra defilamínu

Na vynikajúcich obrazoch sú zastúpené chemické štruktúry difenilamínu. Čierne gule zodpovedajú atómom uhlíka, bielym atómom vodíka a modrou k atómu dusíka.
Rozdiel medzi oboma obrázkami je model toho, ako graficky predstavujú molekulu. V spodnej časti zdôrazňuje aromaticitu krúžkov s čiarami posiatými čiernou farbou a je tiež svedcom plochej geometrie týchto krúžkov.
Ani jeden z týchto dvoch obrázkov neukazuje osamelý pár elektrónov, ktoré nie sú zdieľané na atóme dusíka. Tieto elektróny „prechádzajú“ cez konjugovaný π systém dvojitých väzieb v krúžkoch. Tento systém tvorí akýsi cirkulujúci oblak, ktorý umožňuje intermolekulárne interakcie; to znamená s inými krúžkami z inej molekuly.
Môže vám slúžiť: laboratórny teplomer: Charakteristiky, čo je pre, použitie, príkladyVyššie uvedené znamená, že moment dusíka, ktorý nie je zdieľaný.
V tomto procese sa dostupnosť týchto elektrónov znižuje, čo vedie k zníženiu základnosti dipelamínu (jeho tendencia darovať elektróny ako lewisskú základňu).
Používanie/aplikácie dipenylamínu
Difenylamín je oxidačné činidlo schopné plniť sériu funkcií a medzi nimi sú:
- Počas svojho skladovania zažívajú jablká a hrušky fyziologický proces nazývaný obarenie, súvisiaci s výrobou konjugovaného trénov, čo vedie k poškodeniu kože ovocia. DiPenylamínová akcia umožňuje zvýšiť obdobie skladovania, čím sa zníži poškodenie ovocia na 10 % toho, čo sa pozoruje v ich neprítomnosti.
- Pri boji proti oxidácii difenylamín a jeho deriváty rozširujú fungovanie motorov tým, že sa vyhýbajú zahusťovaniu použitého oleja.
- Difenylamín sa používa na obmedzenie pôsobenia ozónu vo výrobe gumy.
- Difenylamín sa používa v analytickej chémii na detekciu dusičnanov (nie3-), Chlorónii (clo3-) a ďalšie oxidačné činidlá.
- Je to indikátor používaný pri detekčných testoch otravy dusičnanmi.
- Keď sa RNA hydrolyzuje hodinu, reaguje s defilamínom; To umožňuje jeho kvantifikáciu.
- Vo veterinárnej medicíne sa DIPE -Pilamín používa topicky pri prevencii a liečbe prejavov červa boreridu u chovných zvierat.
- Niektoré z derivátov duelamínu patria do kategórie nesteroidných protizápalových liekov. Môžu mať tiež farmakologické a terapeutické účinky, ako sú antimikrobiálne, analgetiká, antikonvulzíva a anti -karcinárna aktivita.
Príprava dipenylamínu
Prirodzene sa defilamín vyrába v cibule, v koriandinách, v listoch zeleného a čierneho čaju a v škrupinách citrusového ovocia. Synteticky existuje veľa trás, ktoré vedú k tejto zlúčenine, napríklad:
Tepelná deaminácia anilínu
Pripravuje sa tepelnou deamináciou anilínu (c6H5NH2) V prítomnosti oxidačných katalyzátorov.
Ak anilín v tejto reakcii nezahŕňa atóm kyslíka do jeho štruktúry, prečo oxidujete? Pretože aromatický kruh je skupina atraktorov elektrónov, na rozdiel od atómu H, ktorý daruje nízku elektronickú hustotu dusíka v molekule.
2 c6H5NH2 => (C5H5)2 NH+NH3
Anilín môže tiež reagovať so soľou anilínu hydrochloridu (C (C6H5NH3+Cl-) pri zahrievaní 230 ° C po dobu dvadsať hodín.
C6H5NH2 + C6H5NH3+Cl- => (C5H5)2 NH
Fenotiazínová reakcia
Dipenylamín pochádza z niekoľkých odvodených v kombinácii s rôznymi činidlami. Jedným z nich je fenotiazín, ktorý syntetizuje so síry.
(C6H5)2NH +2S => S (C6H4) NH +H2Siež

Vlastnosti dipenylamínu
DiPenylamín je biela kryštalická tuhá látka, ktorá v závislosti od jeho nečistôt môže získať bronchneal, jantárové alebo žlté tóny. Má príjemnú kvetinovú arómu, má molekulovú hmotnosť 169,23 g/mol a hustotu 1,2 g/ml.
Molekuly týchto tuhých látok interagujú van der Waalsovými silami, medzi ktorými patria vodíkové mosty tvorené atómami dusíka (NH-NH) a stohovaním aromatických krúžkov, ktoré spočívajú ich „elektronické oblaky“ na druhej strane.
Môže vám slúžiť: zinkový sulfid (Zns)Ako aromatické krúžky veľa zaberajú. Vyššie uvedené spôsobuje, že pevná látka nemá veľmi vysoký bod fúzie (53 ° C).
V kvapalnom stave sú však molekuly samostatnejšie a účinnosť vodíkových mostov sa zlepšuje. Podobne je defilamín relatívne ťažký a potrebuje veľa tepla na presun do plynovej fázy (302 ° C, jeho bod varu). Je to tiež čiastočne spôsobené hmotnosťou a interakciami aromatických krúžkov.
Rozpustnosť a základnosť
Je veľmi nerozpustný vo vode (0,03 g/100 g vody) v dôsledku hydrofóbneho charakteru jej aromatických krúžkov. Namiesto toho je veľmi rozpustný v organických rozpúšťadlách, ako je benzén, tetrachlorid uhlíka (CCL4), acetón, etanol, pyridín, kyselina octová atď.
Jeho kyslosť konštanta (PKA) je 0,79, čo sa týka kyslosti jej konjugovanej kyseliny (C6H5NH3+). Protón pridaný do dusíka má tendenciu sa rozdeliť, pretože pár elektrónov, s ktorými je prepojený, môže prechádzať aromatickými krúžkami. Teda vysoká nestabilita C6H5NH3+ Odráža nízku základnosť difenillamínu.
Odkazy
- Lubrizol Corporation. (2018). Difenylamínové antioxidanty. Zotavený z lubrizolu.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Farmakologické aplikácie difenylamínu a jeho derivátu ako silná bioaktívna zlúčenina: prehľad. Súčasné bioaktívne zlúčeniny, objem 13.
- Prepchem. (2015-2016). Príprava difenylamínu. Získané z prepchemu.com
- Publikácia. (2018). Difenylamín. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Wikipedia. (2018). Difenylamín. Získaný z.Wikipedia.orgán

