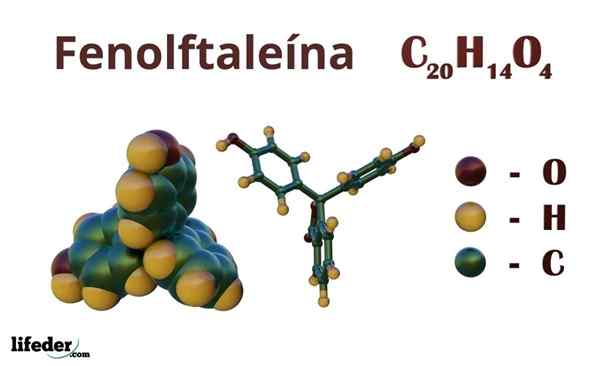
Fenolftaleín (C20H14O4)
- 3625
- 150
- Václav Višňovský
Čo je fenolftaleín?
Ten fenolftaleín Je to organické farbivo, ktoré je zase slabá diprotická kyselina, ktorá sa používa pri mnohých objemových stanoveniach ako indikátor kyseliny bázy. To znamená, že ak je to kyselina diprotická, v roztoku môžete stratiť dva H ióny+, A aby ste boli indikátorom, musíte mať majetok, že ste farební v rozsahu pH, ktorý sa oceňuje.
V základnom médiu (pH> 8) je fenolftaleín ružový, ktorý je možné zintenzívniť na fialovú červenú farbu. Ak sa chcete použiť ako indikátor kyseliny, nemali by ste reagovať rýchlejšie s OH- prostredia, ktoré analyzuje na určenie.
Okrem toho, pretože je to veľmi slabá kyselina, je vylúčená prítomnosť skupín -COOH, a preto je zdrojom kyslých protónov dve OH skupiny spojené s dvoma aromatickými kruhmi.
Vzorec
Fenolftaleín je organická zlúčenina, ktorej kondenzovaný chemický vzorec je CdvadsaťH14Ani4. Aj keď možno nestačí na zistenie, ktoré organické skupiny vlastnia, z vzorca môžete vypočítať nenasýtenie, aby ste začali objasniť svoju kostru.
Chemická štruktúra
 Štruktúra fenolftaleínu
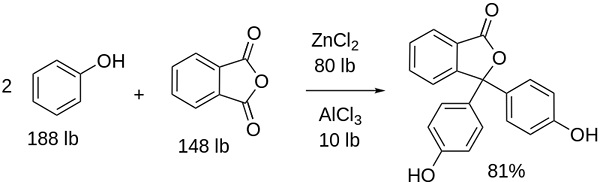
Štruktúra fenolftaleínu Štruktúra fenolftaleínu je dynamická, čo znamená, že prechádza zmenami v závislosti od pH svojho okolia. Na vynikajúcom obraze je ilustrovaná štruktúra fenolftaleínu v rozsahu 0 Je to pentagonálny prsteň, ktorý trpí najväčšími úpravami. Napríklad v základnom médiu, keď jedna z OH skupín fenolových krúžkov, ich negatívne zaťaženie (-o-) je priťahovaný aromatickým prsteňom, ktorý „otvára“ Pentagonálny prsteň v novom usporiadaní jeho odkazov. Tu je nové záporné zaťaženie umiestnené v skupine -Coo-, ktorý „vyšiel“ z pentagonálneho kruhu. Potom, po zvýšení základnosti média, druhá OH skupina fenolových krúžkov a výsledné zaťaženie je ničivé v celej molekulárnej štruktúre. Dolný obrázok sumarizuje výsledok dvoch nedeprotonácií v základnom médiu. Táto štruktúra je zodpovedná za známe ružové sfarbenie fenolftaleínu. Elektróny, ktoré „prechádzajú“ cez konjugovaný systém π (predstavovaný s dvojitými rezonančnými väzbami), absorbujú vo viditeľnom spektre, konkrétne k vlnovej dĺžke žltej farby, odrážajúc ružovú farbu, ktorá dosahuje oko nastávajúceho oka. Fenolftaleín má celkom štyri štruktúry. Predchádzajúce dva sú najdôležitejšie z praktického hľadiska a sú znázornené skrátene ako: h2Dovnútra2-. Fenolftaleín sa používa v chemickej analýze ako vizuálny indikátor pri určovaní bodu ekvivalencie v neutralizačných reakciách alebo v stupňoch kyslých báz. Činidlo pre tieto hodnotenia kyseliny sa pripravuje na 1 % rozpustené v 90 % alkoholu. Phenolphtalein predstavuje 4 štáty: Toto správanie umožnilo použitie fenolftaleínu ako indikáciu karbonácie betónu, ktorý mení pH na hodnotu medzi 8,5 až 9. Zmena sfarbenia je tiež veľmi náhla; to znamená anión v2- Pink sa vyrába pri vysokej rýchlosti. V dôsledku toho vám to umožňuje byť kandidátom ako indikátor v mnohých objemových stanoveniach; Napríklad slabá kyselina (kyselina octová) alebo silná (kyselina chlorovodíková). Fenolftaleín sa použil ako preháňadlo. Existuje však indikatívna vedecká literatúra, že niektoré preháňadlá, ktoré obsahujú fenolftaleín ako aktívny princíp - ktorý pôsobí inhibujúca absorpciu vody a elektrolytov v evakuáciách podporujúcich veľké črevo - by mohli mať negatívne účinky. Dlhodobé používanie týchto liekov, ktoré obsahujú fenolftaleín. Chemicky modifikovaný fenolftaleín a potom ho transformuje do svojho zníženého stavu, používa sa ako činidlo v forenzných testoch, ktoré umožňujú určenie prítomnosti hemoglobínu vo vzorke (Kastle-Meyerov test), čo nie je presvedčivé kvôli prítomnosti falošných pozitív. Vytvára sa kondenzáciou ftalického anhydridu fenolom v prítomnosti koncentrovanej kyseliny sírovej a zmesou chloridov hliníka a zinku ako katalyzátorov reakcie: Aromatická elektrofilná substitúcia je mechanizmus, ktorý riadi túto reakciu. Z čoho pozostáva? Fenolický kruh (molekula vľavo) je negatívne načítaný vďaka atómu kyslíka bohatého na elektróny, ktorý je schopný prinútiť ich bezplatného páru, ktorý precestuje „elektronický obvod“ kruhu. Na druhej strane uhlík skupiny C = o ftalického anhydridu. Fenolický kruh, bohatý na elektróny, útočí na tento zlý uhlík v elektronoch a začleňuje prvý kruh do štruktúry. Tento útok sa vyskytuje prednostne na opačnom konci uhlíka spojeného so skupinou OH; Toto je pozícia -pre. To isté platí pre druhý kruh: útočí na rovnaký uhlík a z toho sa vďaka kyslému médiu uvoľňuje molekula vody. Týmto spôsobom fenolftaleín nie je nič iné ako ftalická molekula anhydridu, ktorá začlenila dva fenolové krúžky do jednej zo svojich skupín Carbonillus (C = O). Jeho fyzický vzhľad je vzhľad bielej tuhej látky s triklinickými kryštálmi, často aglomerovanými alebo vo forme kosoštvorcových ihiel. Je to toaleta, hustejšia ako kvapalná voda (1 277 g/ml pri 32 ° C) a veľmi málo prchavých (odhadovaný tlak pary: 6,7 x 10-13 mmhg). Je veľmi málo rozpustný vo vode (400 mg/l), ale veľmi rozpustný v alkoholu a éteru. Z tohto dôvodu sa odporúča zriediť ho v etanole pred použitím. Je nerozpustný v aromatických rozpúšťadlách, ako je benzén a toluén, alebo v alifatických uhľovodíkoch, ako je n-hexán. Nájdené pri 262,5 ° C a kvapalina má bod varu 557,8 ± 50,0 ° C na atmosférický tlak. Tieto hodnoty naznačujú silné intermolekulárne interakcie. Dôvodom je vodíkové mosty, ako aj predné interakcie medzi krúžkami. Jeho pka je 9,7 až 25 ° C. To sa premieta do veľmi nízkeho trendu disociácie vo vodnom médiu: H2V (ac) + 2h2Alebo (l) v2-(Ac) + 2h3Ani+ Toto je vodná rovnováha. Zvýšenie OH iónov však- V roztoku súčasné množstvo H klesá3Ani+. V dôsledku toho sa rovnováha pohybuje doprava, aby sa vytvorila viac h3Ani+. Týmto spôsobom je jeho počiatočná strata odmenená. Keď sa pridá viac základne, rovnováha sa naďalej pohybuje doprava, a tak ďalej, kým nie je nič z druhu h2V. V tomto bode druh v2- Rosado zafarbuje riešenie. Nakoniec sa fenolftaleín rozkladá pri zahrievaní, emitovaní akra a dráždivého dymu.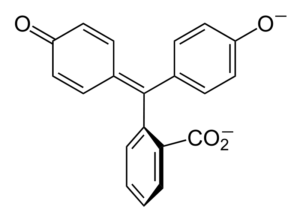
Použitie/aplikácie fenolftaleínu
 Pridanie alkalického roztoku do neutrálneho roztoku s indikátorom fenolftaleínu
Pridanie alkalického roztoku do neutrálneho roztoku s indikátorom fenolftaleínu Indikátor
Použitie v medicíne
Syntéza fenolftaleínu
Vlastnosti fenolftaleínu
Odkazy