Hromadné číslo, z čoho pozostáva a ako ho získať (s príkladmi)
- 5084
- 1354
- Tomáš Mydlo
On Hromadné číslo o Hmotné číslo atómu je súčet počtu protónov a množstvo neutrónov jadra. Tieto častice sú označené zameniteľne s názvom Jadro, Číslo hmotnosti preto predstavuje ich množstvo.
Nech n je počet prítomných neutrónov a z počtu protónov, ak nazývame číslo hmotnosti, potom:
A = n + z
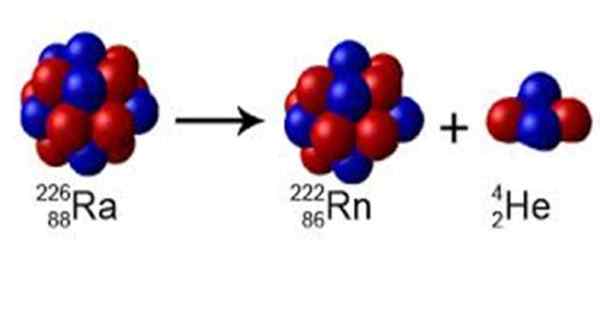
 postava 1. Rádio má hmotnosť A = 226, rozpadá sa na radón s a = 222 a emituje jadro hélia A = 4. Zdroj: Wikimedia Commons. Perox [CC0] [TOC]
postava 1. Rádio má hmotnosť A = 226, rozpadá sa na radón s a = 222 a emituje jadro hélia A = 4. Zdroj: Wikimedia Commons. Perox [CC0] [TOC]
Príklady hromadných čísel
Okamžite niekoľko príkladov hromadných čísel pre dobre známe prvky:
Vodík
Najstabilnejší a najhojnejší atóm vodíka je tiež najjednoduchší: 1 protón a elektrón. Pretože vodíkové jadro nemá neutróny, je pravda, že a = z = 1.
Kyslík
Kyslíkové jadro má 8 neutrónov a 8 protónov, preto A = 16.
Uhlík
Život na Zemi je založený na chémii uhlíka, ľahkého atómu so 6 protónmi v jadre plus 6 neutrónov, ako a = 6 + 6 = 12.
Urán
Tento ťažký prvok ako predchádzajúci je dobre známy svojimi rádioaktívnymi vlastnosťami. Jadro uránu má 92 protónov a 146 neutrónov. Potom je vaše hmotnostné číslo a = 92 + 146 = 238.
Ako získať hromadné číslo?
Ako už bolo povedané, hmotnostné číslo A prvku vždy zodpovedá súčtu počtu protónov a počtu neutrónov obsahujúcich jeho jadro. Je to tiež celé číslo, ale ... existuje akékoľvek pravidlo, pokiaľ ide o vzťah medzi oboma množstvami?
Pozrime sa: Všetky vyššie uvedené prvky sú ľahké, okrem uránu. Atóm vodíka je, ako sme povedali, najjednoduchší. Nemá žiadne neutróny, aspoň vo svojej najhojnejšej verzii a v kyslíku a uhlíku existuje rovnaký počet protónov a neutrónov.
Môže vám slúžiť: Čo je to emisné utierky? (S príkladmi)Stáva sa to tiež s inými svetelnými prvkami, ako je dusík, ďalší veľmi dôležitý plyn pre život, ktorý má 7 protónov a 7 neutrónov. Avšak, keď je jadro zložitejšie a atómy sa stávajú ťažším, počet neutrónov sa zvyšuje s iným rytmom.
Na rozdiel od svetelných prvkov má urán s 92 protónmi približne 1 ½ násobok tohto množstva v neutrónov: 1 ½ x 92 = 1.5 x 92 = 138.
Ako vidíte, je to celkom blízko 146, množstvo neutrónov, ktoré má.
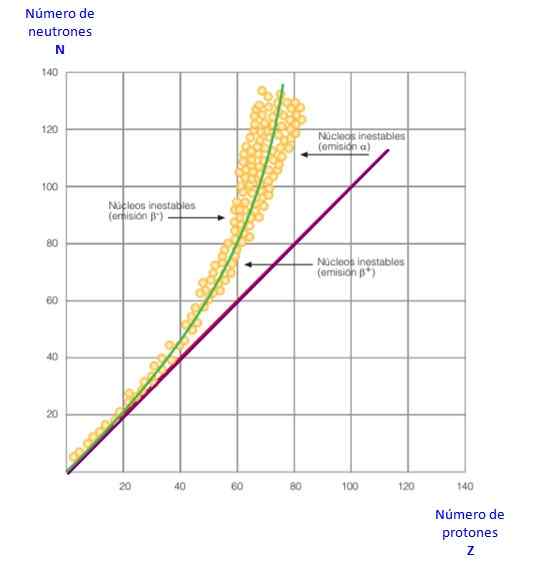 Obrázok 2. Krivka stability. Zdroj: f. Zapata.
Obrázok 2. Krivka stability. Zdroj: f. Zapata. To všetko je zrejmé v krivke obrázku 2. Je to graf n versus z, známy ako z krivka jadrovej stability. Tam je vidieť, ako majú atómy svetla rovnaký počet protónov ako neutrón a ako zo z = 20 počet neutrónov sa zvyšuje.
Týmto spôsobom sa veľký atóm stáva stabilnejším, pretože nadmerné neutróny znižujú elektrostatické odpudenie medzi protónmi.
Notácia pre atómy
Veľmi užitočná notácia, ktorá rýchlo popisuje typ atómu, je nasledujúci: Symbol prvku a príslušné atómové a hmotnostné čísla sú napísané, ako je uvedené nižšie v tejto schéme:
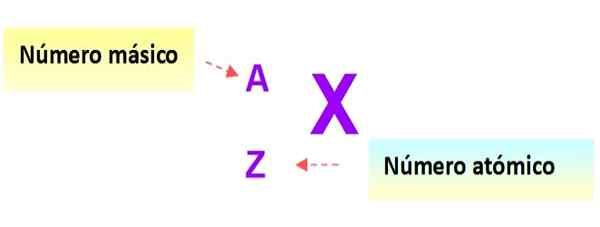 Obrázok 3. Atómový zápis. Zdroj: f. Zapata.
Obrázok 3. Atómový zápis. Zdroj: f. Zapata. V tomto zápise by atómy predchádzajúcich príkladov boli:

Niekedy sa používa ďalšia pohodlnejšia notácia, v ktorej sa používa iba symbol prvku a hmotnosti na označenie atómu, ktorý vynechá atómové číslo. Takto, 12 6C je napísaný jednoducho ako uhlík-12, 16 8Alebo by to bolo kyslík-16 a tak pre akýkoľvek prvok.
Môže vám slúžiť: polkruh: Ako vypočítať obvod, oblasť, centroid, cvičeniaIzotopy
Počet protónov v jadre určuje povahu prvku. Napríklad každý atóm, ktorého jadro obsahuje 29 protónov, je atóm medi, nech sa stane čokoľvek.
Predpokladajme, že atóm medi stratí elektrón z akéhokoľvek dôvodu, napriek tomu je stále meď. Teraz je to však ionizovaný atóm.
Pre atómové jadro je ťažšie vyhrať alebo stratiť protón, ale v prírode sa môže vyskytnúť. Napríklad vo vnútri hviezd sú nepretržite formované ťažšie prvky z svetelných prvkov, pretože jadro Star sa správa ako fúzny reaktor.
A práve tu na zemi je jav rádioaktívne rozpadnutie, v ktorých niektoré nestabilné atómy vylučujú nukleóny a vyžarujú energiu, transformujúc sa na iné prvky.
Nakoniec existuje možnosť, že atóm určitého prvku má iné hmotnostné číslo, v tomto prípade je to izotop.
Dobrým príkladom je známy uhlík-14 alebo rádiokarbík, ktorý sa používa do dnešného dňa archeologických predmetov a ako biochemický indikátor. Je to rovnaký uhlík s rovnakými chemickými vlastnosťami, ale s dvoma ďalšími neutrónmi.
Uhlík-14 je menej hojný ako uhlík-12, stabilný izotop a je tiež rádioaktívny. To znamená, že v priebehu času sa rozpadá emitovaním energie a častíc, kým sa nestane stabilným prvkom, ktorým je v jeho prípade dusík.
Uhlíkové izotopy
Uhlík v prírode existuje ako zmes niekoľkých izotopov, z ktorých najhojnejšia je vyššie uvedená 12 6C alebo uhlík-12. A okrem uhlíka-14 je 13 6C s ďalším neutrónom.
Môže vám slúžiť: striedanie aktuálnych obvodov: typy, aplikácie, príkladyToto je v podstate, napríklad CIN, je známych 10 stabilných izotopov. Na druhej strane je jediný izotop známy ako berylia a sodík.
Každý izotop, prírodný alebo umelý, má odlišný rytmus transformácie. Rovnakým spôsobom je možné vytvoriť umelé izotopy v laboratóriu, ktoré sú zvyčajne nestabilné a rozpadajú rádioaktívne vo veľmi krátkom období druhých frakcií, zatiaľ čo iní berú oveľa viac, rovnako ako vek Zeme alebo viac.
Tabuľka izotopov s prírodným uhlíkom
| Uhlíkové izotopy | Atómové číslo z | Hromadné číslo a | Hojnosť % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.jedenásť |
| 14 6 C | 6 | 14 | Stopy |
Vyriešené príklady
- Príklad 1
Aký je rozdiel medzi 13 7 N a 14 7 N?
Odpoveď
Obidve sú atómy dusíka, pretože ich atómové číslo je 7. Jeden z izotopov, ktorý má A = 13, má však menej neutrón, zatiaľ čo 14 7 N je najhojnejší izotop.
- Príklad 2
Koľko neutrónov je v jadre atómu ortuti, označených ako 201 80 Hg?
Odpoveď
Pretože a = 201 a z = 80, a tiež to vedia:
A = z + n
N = a - z = 201 - 80 = 121
A dospelo sa k záveru, že atóm ortuti má 121 neutrónov.
Odkazy
- Connor, n. Čo je nukleón - štruktúra atómového jadra - definícia. Zdroj: Periodic-Grable.orgán.
- Rytier, r. 2017. Fyzika pre vedcov a inžinierstvo: Strategický prístup. Pearson.
- Sears, Zemansky. 2016. Fyzika univerzity s modernou fyzikou. 14. Edimatizovať. Zväzok 2.
- Tippens, P. 2011. Fyzika: Koncepty a aplikácie. 7. vydanie. McGraw Hill.
- Wikipedia. Hromadné číslo. Zdroj: In.Wikipedia.orgán.
- « Dusičnan horečnatý (Mg (NO3) 2) Štruktúra, vlastnosti, používa
- Coplanares bodový rovnica, príklad a vyriešené cvičenia »

