Dusičnan horečnatý (Mg (NO3) 2) Štruktúra, vlastnosti, používa

- 2095
- 590
- Valentín Dula
On Dusičnan horečnatého Je to anorganická tuhá látka, ktorej chemický vzorec je mg (nie3)2. Je to iónová zlúčenina tvorená spojením katiónu horčíka MAG2+ a dva dusičnany3-.
Mg (nie3)2 Je to kryštalická biela pevná látka. Je to veľmi hygroskopické, to znamená, že ľahko absorbuje vodu z prostredia. Tým, že zostane v kontakte so vzduchom životného prostredia, má tendenciu vytvárať jeho hexahydrát MG (nie3)2 •6H2Ani.
 Mg dusičnan horčík (nie3)2 práškový. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons.
Mg dusičnan horčík (nie3)2 práškový. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons. Mag dusičnan hexahydrát (nie3)2 •6H2O má vo svojej kryštalickej štruktúre 6 molekúl vody h2Alebo pre každú molekulu mg (nie3)2. Dusičnan horečnatý sa nachádza v jaskyniach a baniach vo forme nitromagnesitského minerálu.
Mg (nie3)2 Získava sa komerčne reagovaním kovového kovu Mg s kyselinou dusičnou HNO3.
Má veľmi rozmanité použitie, ako je napríklad poľnohospodárstvo ako hnojivo, pretože poskytuje výživné prvky pre rastliny ako dusík (N) a horčík (MG).
Používa sa v priemysle ohňostrojov alebo pyrotechniky a tiež pri získavaní koncentrovanej kyseliny dusičnej. Používa sa v chemickej analýze, v experimentoch fyziky a lekárskych a vedeckých štúdiách.
[TOC]
Štruktúra
Dusičnan horčíka anhydro je tvorený magnezio mg katiónom2+ a dva dusičnany3-.
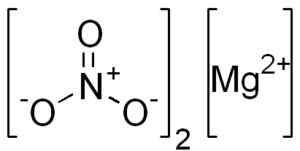 Štruktúra mg (nie3)2. EDGAR181 [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra mg (nie3)2. EDGAR181 [verejná doména]. Zdroj: Wikimedia Commons. Magnezio mg ión2+ Má elektronickú konfiguráciu: 1s2, 2s2 2 P6, 3s0, Dva elektróny najvzdialenejšej vrstvy (3s) sa poskytli. Táto konformácia je veľmi stabilná.
Ion nie3- Má plochú a symetrickú štruktúru.
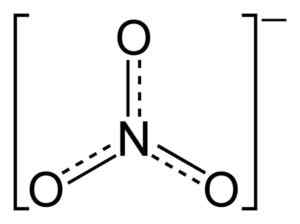 Štruktúra iónových dusičnanov č3-. Bodkované čiary označujú spravodlivé rozdelenie elektrónov medzi tromi väzbami N-O. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra iónových dusičnanov č3-. Bodkované čiary označujú spravodlivé rozdelenie elektrónov medzi tromi väzbami N-O. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. V štruktúre NO3- Záporné zaťaženie je nepretržite rozdelené medzi tri atómy kyslíka.
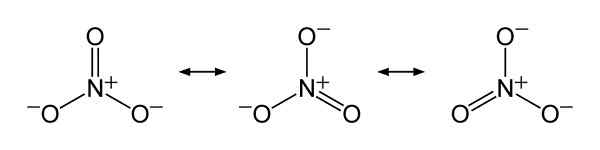 Štruktúry rezonancie dusičnanov3-, Na vysvetlenie spravodlivého rozdelenia negatívneho zaťaženia medzi tromi atómami kyslíka. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúry rezonancie dusičnanov3-, Na vysvetlenie spravodlivého rozdelenia negatívneho zaťaženia medzi tromi atómami kyslíka. Benjah-Bmm27 [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
-Anhydro dusičnan horčík: mg (nie3)2
Môže vám slúžiť: destilovaná voda-Dihydratovaný dusičnan horečnatý: mg (nie3)2 •2h2Ani
-Hexahydrátový dusičnan horčík: mg (nie3)2 •6H2Ani
-Horčík
Vlastnosti
Fyzický stav
-Mg (nie3)2 Bezvodý: biele pevné, kubické kryštály.
-Mg (nie3)2 Dihydrado: kryštalická biela pevná látka.
-Mg (nie3)2 Hexahided: bezfarebná pevná, monoklinická kryštály
Molekulová hmotnosť
-Mg (nie3)2 Bezvodý: 148,31 g/mol
-Mg (nie3)2 Hexahydrát: 256,41 g/mol
Bod topenia
-Mg (nie3)2 Hexahydrát: 88,9 ° C
Bod varu
-Mg (nie3)2 Hexahydrát: Nevvarujte, rozkladajte sa pri 330 ° C
Hustota
-Mg (nie3)2 Bezvodý: 2,32 g/cm3
-Mg (nie3)2 Dihydrared: 1 456 g/cm3
-Mg (nie3)2 Hexahydrát: 1 464 g/cm3
Rozpustnosť
Dusičnan anhydro horčík je veľmi rozpustný vo vode: 62,1 g/100 ml pri 0 ° C; 69,5 g/100 ml pri 20 ° C. Je tiež veľmi hygroskopický, je v kontakte so vzduchom rýchlo vytvára hexahydrát.
Mg (nie3)2 Dihydrado je tiež veľmi rozpustný vo vode a etanole. Je hygroskopický.
Mg (nie3)2 Hexahydrát je tiež veľmi rozpustný vo vode. Je mierne rozpustný v etanole. Je to najstabilnejší z troch v kontakte so vzduchom, to znamená, že z týchto troch je ten, ktorý najmenej absorbuje vodu z životného prostredia.
Vykurovanie
Predložením vodného roztoku mg (nie3)2 Na odparovanie vody je soľ, ktorá kryštalizuje, hexahydrát: mg (nie3)2 •6H2Ani. Hexahydrát znamená, že v tuhej molekule mg (nie3)2 Je spojený so 6 molekulami vody.
K dispozícii je tiež mg dihydrát (nie3)2 •2h2Alebo, v ktorom mg (nie3)2 tuhá látka je pripevnená na 2 molekuly vody.
Zahrievanie mg hexahydrátu (nie3)2 •6H2Alebo sa nezískava anhydra soľ, pretože dusičnan horečnatý má vysokú afinitu k vode.
Z tohto dôvodu jeho zahrievaním nad jeho topením, zmiešanou dusičnanou soľou a hydroxidom horečnatým mg (nie3)2 •4 mg (OH)2.
Táto zmiešaná soľ, keď dosiahne 400 ° C, sa rozkladá na oxid horečnatý a oddeľuje plyny oxidov dusíka.
Môže vám slúžiť: chlórnan vápenatý (CA (CLO) 2)Získanie
Môže sa pripraviť reagovaním uhličitanu horčíka MGCO3 S kyselinou dusičnou HNO3, vzdanie sa oxidu uhličitého2:
Mgco3 + 2 hno3 → mg (nie3)2 + Co2↑ + h2Ani
Môže sa tiež získať pomocou hydroxidu horčíka Mg (OH)2 a kyselina dusičná:
Mg (oh)2 + 2 hno3 → mg (nie3)2 + 2 h2Ani
Komerčne získané niekoľkými spôsobmi:
1- Reaktory magnezio mg s kyselinou dusičnou HNO3.
2- reakciou oxidu horečnatého MGO s HNO kyseliny dusičnej3.
3- spájanie hydroxidu horčíka Mg (OH)2 a dusičnan amónny NH4Nie3, formovanie dusičnanu horečnatého s odlúčením amoniaku NH3.
Miesto v prírode
Mg (nie3)2 Hexahydrát sa prirodzene nachádza v baniach a jaskýňoch alebo jaskýňoch vo forme nitromagnesitského minerálu.
Tento minerál je prítomný, keď guano prichádza do kontaktu s bohatými skalami v horčíku. Guan je materiál vyplývajúci z exkrementu morských vtákov a tesnení vo veľmi suchom prostredí.
Žiadosti
Mg (nie3)2 Hexahydrát sa používa v keramickom, chémiovom a poľnohospodárskom priemysle.
Táto zlúčenina je hnojivo, pretože poskytuje dusík (N), ktorý je jedným z troch základných prvkov požadovaných rastlinami a horčík (MG), ktorý je tiež pre nich dôležitý sekundárny zložka.
Týmto spôsobom sa používa s inými zložkami v skleníkoch a v hydroponickej kultúre. Posledne menované je pestovať rastliny vo vodnom roztoku s hnojivovými soľami namiesto pôdy.
 Hydroponická kultúra. Môžete vidieť kanály, cez ktoré sa cirkuluje vodný roztok s hnojivovými soľami, ako je Mg3)2. Autor: Marsraw. Zdroj: Pixabay.
Hydroponická kultúra. Môžete vidieť kanály, cez ktoré sa cirkuluje vodný roztok s hnojivovými soľami, ako je Mg3)2. Autor: Marsraw. Zdroj: Pixabay. Používa sa tiež ako katalyzátor pri získavaní petrochemických zlúčenín. Umožňuje prispôsobiť viskozitu v určitých procesoch. Dusičnan horčík Anhydro sa používa v pyrotechnike, tj pre výrobu ohňostrojov.
 Ohňostroje obsahujú dusičnan horčík Mg (nie3)2. Autor: Free Goos. Zdroj: Pixabay.
Ohňostroje obsahujú dusičnan horčík Mg (nie3)2. Autor: Free Goos. Zdroj: Pixabay. Anhydro dusičnan horčík je dehydratačné činidlo. Používa sa napríklad na získanie koncentrovanej kyseliny dusičnej, pretože eliminuje vodu a koncentruje kyslé výpary až do 90-95% HNOS3.
Môže vám slúžiť: Diagonálne pravidlo Koncentrovaná kyselina dusičná. Pôvodný nováčik bol v talianskej Wikipédii fabuxpozitívny. [Gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Zdroj: Wikimedia Commons.
Koncentrovaná kyselina dusičná. Pôvodný nováčik bol v talianskej Wikipédii fabuxpozitívny. [Gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Zdroj: Wikimedia Commons. Používa sa tiež na pokrytie dusičnanu amónneho a umožnenie tvorby perly uvedeného komprimovaného materiálu.
Má užitočnosť v atramentovej formulácii, toner (čierny prášok používaný vo fotokopovaných systémoch) a sfarbenie výrobkov. V analytickej chémii slúži ako štandard horčíka.
Horčík a cerio mg dusičnanová soľ (nie3)2 •Zamračiť sa3)3 Je zaujímavé pre experimenty s fyzikou pri nízkych teplotách, pretože sa používa ako chladivo v experimentoch adiabatickej sumagnetizácie (bez prenosu tepla).
Tento horčík a cerio soľ sa používa na stanovenie extrémne nízkych hladín stupnice Kelvin (blízko absolútneho nuly).
V nedávnych štúdiách
Niekoľko vedcov použilo MG (nie3)2 V kompozíciách so syntetickými a prírodnými polymérmi na zvýšenie vodivosti v magnezio batériách.
Bol tiež skúmaný pri výstavbe supercaugád pre vysoké úložisko energie.
V štúdiách chorôb
Dusičnan horečnatý sa podáva laboratórnym potkanom s arteriálnou hypertenziou (vysoký tlak) a zistilo sa, že krvný tlak účinne znižuje a zoslabuje alebo zjemňuje účinky komplikácií tohto ochorenia.
Ukázala tiež ochranné účinky proti neurologickým poruchám (porucha v neurónoch) a proti smrti u potkanov počas kaktónových procesov karotidovej tepny.
Odkazy
- Qian, m. a kol. (2018). Extrainárne porézne niečo, čo. Rozhrania Appl Mater 2018, 10 (1): 381-388. NCBI sa zotavila.NLM.NIH.Vláda.
- Manjuladevi, r. a kol. (2018). Štúdia o elektrolyte polyméru zmesi založená na Poly. Ionics (2018) 24: 3493. Odkaz obnovený.Prubár.com.
- Kiruthika, s. a kol. (2019). Ekologický biopolymér elektrolyt, pektín s dusičnanom horečnatého, na aplikáciu vo elektochemických zariadeniach. J Solid State Electochem (2019) 23: 2181. Odkaz obnovený.Prubár.com.
- Vilskerts r. a kol. (2014). Dusičnan horčík zoslabuje krvný tlak u potkanov SHR. Magnes Res 2014, 27 (1): 16-24. NCBI sa zotavila.NLM.NIH.Vláda.
- Kuzenkov v.Siež. a Krushinskii a.L. (2014). Ochranný účinok dusičnanu horečnatého proti neurologickým poruchám vyvolaný mozgovou ischémiou u potkanov. Bull Exp Biol Med 2014, 157 (6): 721-3. NCBI sa zotavila.NLM.NIH.Vláda.
- Ropp, r.C. (2013). Skupina 15 (N, P, AS, SB a BI) Alkalické zlúčeniny Zeme. Dusičnan horečnatého. V encyklopédii alkalických Zemech Zeme. Zotavené z vedeckých pracovníkov.com.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 1. Štvrté vydanie. John Wiley & Sons.
- Alebo.Siež. Lekárska knižnica. (2019). Dusičnan horečnatého. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- « Koncepcia a charakteristiky technického systému, prvky, príklady
- Hromadné číslo, z čoho pozostáva a ako ho získať (s príkladmi) »

