Vlastnosti nitrilu, nomenklatúra, použitia, príklady

- 1584
- 84
- Tomáš Mydlo
Ten Nitrily Sú to všetky tie organické zlúčeniny, ktoré majú funkčnú skupinu CN, ktorá sa tiež nazýva kyano skupina alebo kyanid, pokiaľ ide o anorganickú chémiu. Alifatické dusičnany sú zastúpené so všeobecným vzorcom RCN, zatiaľ čo aromatické nitrily s ARCN Formule.
Aj keď vodíkový kyanid, HCN a soli kyanidových kovov sú vysoko toxické zlúčeniny, presne to isté sa nestane u nitrilov. Skupina CN v uhlíkovej kostre akéhokoľvek druhu (rozvetvená, lineárna, aromatická atď.), správa sa diagonálne odlišne od aniónu kyanidu, cn-.
 Všeobecný vzorec pre alifatický nitril. Zdroj: Benjah-Bmm27 Via Wikipedia.
Všeobecný vzorec pre alifatický nitril. Zdroj: Benjah-Bmm27 Via Wikipedia. Nitrily sú vo svete plastov veľmi šírené2CHCN, nitril, s ktorým sa syntetizujú polyméry, ako sú gumy nitrilu, používané na chirurgické alebo laboratórne rukavice. Nitrily sú tiež prítomné v mnohých prírodných a farmaceutických výrobkoch.
Na druhej strane sú nitrily prekurzormi karboxylových kyselín, pretože ich hydrolýza predstavuje alternatívnu metódu syntézy na získanie druhej.
[TOC]
Charakteristiky a vlastnosti
Štruktúra
Molekulárne štruktúry nitrilov sa líšia v závislosti od identity R alebo AR v zlúčeninách RCN alebo ARCN.
Geometria CN Group je však lineárna kvôli jeho trojitému prepojeniu, C≡N, čo je produktom hybridizácie SP. Atómy C-C-C-C sú teda umiestnené v rovnakej línii. Okrem týchto atómov môže existovať nejaká štruktúra.
Polarita
Nitrily sú polárne zlúčeniny, pretože dusík skupiny CN je veľmi elektronegatívny a priťahuje elektróny k sebe. Preto majú body fúzie alebo varu vyššie ako ich homológovia.
Môže vám slúžiť: Scandio: História, vlastnosti, reakcie, riziká a použitiaNapríklad acetonitril, cho3CN, je to kvapalina, ktorá vrie na 82 ° C; Zatiaľ čo etano, ch3Chvály3, Je to plyn, ktorý vrie na -89 ° C. Všimnite si veľký účinok, ktorý má skupina CN na intermolekulárne interakcie.
Rovnaké zdôvodnenie sa vzťahuje na väčšie zlúčeniny: ak majú vo svojej štruktúre jednu alebo viac skupín CN, je celkom pravdepodobné, že ich polarita sa zvýši a viac súvisí s povrchmi alebo polárnymi kvapalinami.
Základnosť
Dalo by sa predpokladať, že v dôsledku vysokej polarity nitrilov sú to relatívne silné základne pred aminami. Musíme však brať do úvahy kovalentné väzby C≡N a skutočnosť, že uhlík aj vodík majú hybridizáciu SP.
Základnosť RCN: Je reprezentovaná prijatím protónu z vody: Voda:
RCN: + H2Alebo ⇌ rcnh+ + Oh-
Na potlačenie RCN: moment elektrónového momentu na dusíku musí tvoriť spojenie s iónom H+. Existuje však nepríjemnosť: hybridizácia dusíka ju robí príliš elektronegatívnou, natoľko, že tento pár elektrónov je veľmi silne priťahovaný a nedovolí sa formovať väzba.
Preto sa hovorí, že dusík Sper pár dusíka nie je k dispozícii a že základnosť nitrilov je veľmi nízka. V skutočnosti sú nitrily milióny krát menej základné ako amíny.
Reaktivita
Medzi najreprezentatívnejšie reakcie nitrilov máme ich hydrolýzu a redukciu. Táto hydrolýza je sprostredkovaná kyslosťou alebo zásaditosti vodného prostredia, čo spôsobuje kyselinu karboxylovú alebo karboxylátovú soľ:
Môže vám slúžiť: rovnováha kvapaliny-vaporRCN + 2H2O + HCl → rCoOH + NH4Cl
RCN + H2O + NaOH → rcona + nh3
V tomto procese sa tiež vytvorí Amida.
Nitrily sa redukujú na amíny pomocou katalyzátorov vodíka a kovov:
RCN → RCH2NH2
Menovanie
Podľa nomenklatúry IUPAC sú dusičnany pomenované pridaním prípony -nitril k názvu alkánového reťazca, z ktorého odvodzuje, vrátane uhlíka kyano. Tak, Cho3CN sa nazýva Ethanonitrila a Cho3Chvály2Chvály2CN, butanonitril.
Môžu byť tiež vymenovaní z názvu karboxylovej kyseliny, ktorá je eliminovaná slovom „kyselina“, a prípony sú nahradené -oic alebo -oico príponou -onitrilom. Napríklad pre ch3CN by bol acetonitril (kyselina octová); Za c6H5CN, bol by to benzonitril (kyseliny benzoovej); A pre neho (Cho3)2Chcn, 2-metylpropanitril.
Alternatívne, ak sa uvažujú o menách alquiliciových substituentov, môžu byť uvedené nitrily pomocou slova „kyanid“. Napríklad Cho3CN by sa potom nazýval metylyanid a (Cho3)2CHCN, izopropylikakanid.
Žiadosti
Nitrily sú súčasťou prírodných produktov, ktoré sú v horkých mandľoch, v kosťoch rôznych ovocia, v morských zvieratách, rastlinách a baktériách.
Jeho skupiny CN tvoria štruktúry kyanogénnych lipidov a glykozidov, biomolekúl, ktoré pri degradovaných uvoľňovaní kyanidu vodíka, HCN, vysoko jedovatý plyn. Preto majú bezprostredné biologické využitie pre určité stvorenia.
Predtým sa hovorilo, že skupiny CN dávajú molekulám veľa polarity a v skutočnosti nebudú bez povšimnutia, keď sú prítomné v zlúčeninách s farmakologickou aktivitou. Takéto lieky na nitrily sa používajú na boj proti hyperglykémii, rakovine prsníka, cukrovky, psychózy, depresie a iných porúch.
Môže vám slúžiť: nezvratná reakcia: Charakteristiky a príkladyOkrem toho, že majú úlohu v biológii a medicíne, priemyselne tvoria hŕstku nitrilových plastov, s ktorými sa vyrábajú chirurgické a laboratórne rukavice, známky automobilových častí, hadíc a kĺbov kvôli ich odporu proti korózii a tukom, materiálom, ako sú materiály, ako sú materiály, materiály ako Tupperware, hudobné nástroje alebo bloky Legos.
Nitrilové príklady
Ďalej a nakoniec budú uvedené niekoľko príkladov nitrilov.
Nitril
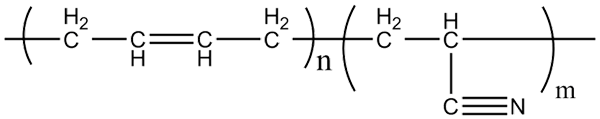 Molekulárna štruktúra copolymérov Acrilonitril-butadieén. Zdroj: Klever cez Wikipedia.
Molekulárna štruktúra copolymérov Acrilonitril-butadieén. Zdroj: Klever cez Wikipedia. Nitril Gumber, s ktorou sa vyrábajú vyššie uvedené rukavice a materiály, ktoré sú odolné voči tuku, je kopolymér tvorený akrilonitrilom a butadiénom (vyššie). Všimnite si, ako vyzerá lineárna skupina CN.
Ciamemazín
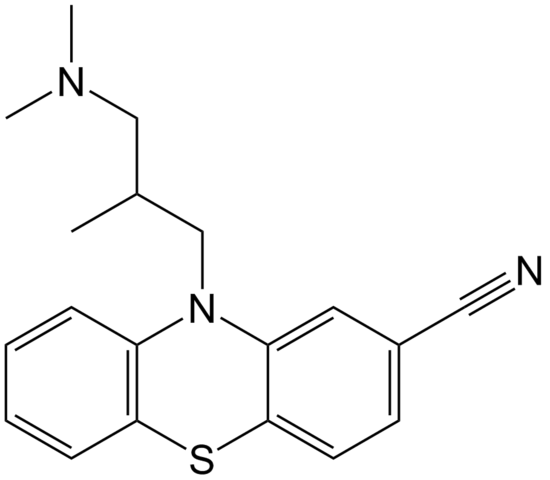 Molekulárna štruktúra cipemazínu. Zdroj: doména EPOP / Pub
Molekulárna štruktúra cipemazínu. Zdroj: doména EPOP / Pub Kyammazín je príkladom nitrilu v oblasti farmácie, ktorý sa používa ako antipsychotikum, konkrétne na liečbu porúch úzkosti a schizofrénie. Opäť si všimnite linearita skupiny CN.
Citalopram
 Ďalším liekom na nitril je citalopram, ktorý sa používa ako antidepresívum
Ďalším liekom na nitril je citalopram, ktorý sa používa ako antidepresívum Amygdalin
 Molekulárna štruktúra tonzilínu. Zdroj: Wesalius / verejná doména
Molekulárna štruktúra tonzilínu. Zdroj: Wesalius / verejná doména Tonsil je príkladom kyanogénneho glucóside. Nachádza sa v horkých mandliach, slivkách, marhuliach a broskyniach. Všimnite si, ako malá skupina CN vyzerá, pokiaľ ide o zvyšok štruktúry; Napriek tomu je jej jediná prítomnosť dostatočná na poskytnutie jedinečnej chemickej identity pre tento uhľohydrát.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitril. Zdroj: In.Wikipedia.orgán
- Chémia librettexts. (5. júna 2019). Chémia nitrilov. Získané z: Chem.Librettexts.orgán
- Jim Clark. (2016). Hydrolyzné nitrily. Získané z: Chemguide.co.Uk
- Ivy Rose Holistic. (2020). Pomenovanie nitrilu. Zdroj: ivyrose.com
- Germán Fernández. (s.F.). Nomenklatúra nitrilu: pravidlá IUPAC. Získané z: chemicicaorganica.orgán
- « 8 hlavných psychologických prúdov a ich autori
- Štruktúra metilamínu, vlastnosti, výroba, použitie »

