Štruktúra metilamínu, vlastnosti, výroba, použitie
- 984
- 205
- Adrián Fajnor
Ten Metilamín Je to organická zlúčenina, ktorej kondenzovaný vzorec je Cho3NH2. Konkrétne je to najjednoduchší primárny alkyamín zo všetkých, pretože obsahuje iba alquilalický substituent, ktorý je rovnaký ako tvrdenie, že existuje iba jedno c-n kovalentné spojenie.
Za normálnych podmienok je to plyn amoniaku, ktorý vonia ako ryby, ale to sa relatívne ľahko kondenzuje a prepravuje v hermetických nádržiach. Podobne sa môže výrazne rozpustiť vo vode, čo spôsobuje žltkasté roztoky. Na druhej strane, môže sa tiež transportovať ako tuhá podoba vašej hydrochloridovej soli, ch3NH2· HCl.
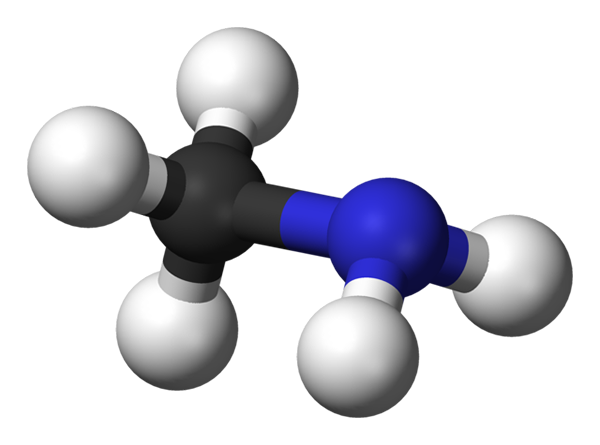
 Molekula metilamínu. Zdroj: Benjah-Bmm27 Via Wikipedia.
Molekula metilamínu. Zdroj: Benjah-Bmm27 Via Wikipedia. Metilamín sa vyskytuje priemyselne z amoniaku a metanolu, hoci v laboratórnych mierkach existuje mnoho ďalších výrobných metód. Jeho plyn je vysoko výbušný, takže akýkoľvek zdroj tepla, ktorý je blízko neho, má potenciál spôsobiť veľký oheň.
Je to zlúčenina s vysokým obchodným dopytom, ale zároveň predstavuje silné právne obmedzenia, pretože slúži ako surovina pre drogy a psychotropné látky.
[TOC]
Štruktúra
Obrázok vyššie zobrazuje molekulárnu štruktúru metylamínu predstavovanú modelom guľôčok a stĺpcov. Čierna guľa zodpovedá atómu uhlíka, modrej atómu dusíka a bielym atómom vodíka. Je to preto malá molekula, kde metán, cho,4, Stratiť H pre skupinu NH2, dávanie CH3NH2.
Metilamín je vysoko polárna molekula, pretože atóm dusíka priťahuje elektronickú hustotu uhlíka a atómy vodíka. Má schopnosť tiež tvoriť vodíkové mosty medzi kompendiom svojich intermolekulárnych síl. Každá molekula ch3NH2 Môžete darovať alebo prijať po sebe idúci vodíkový most (ch3Hnh-nh2Chvály3).
Môže vám slúžiť: Čo je teória kapely?Jeho molekulárna hmotnosť je však značne nízka, okrem portov ch3 Bránia takým vodíkovým mostom. Výsledkom je, že metylamín je plyn za normálnych podmienok, ale to sa môže kondenzovať pri teplote -6 ° C. Pri kryštalizácii to robí podľa ortorbickej štruktúry.
Vlastnosti
Fyzický vzhľad
Farebný plyn alebo kvapalina, ale ktorých vodné roztoky môžu prezentovať žltkasté tóny.
Vôňa
Nepríjemné, podobné zmesi rýb a amoniaku.
Molárna hmota
31 058 g/mol
Bod topenia
-93,10 ° C
Bod varu
Okolo -6 ° C. Preto je to plyn, ktorý dokáže kondenzovať pri príliš chladných teplotách.
Hustota
656,2 kg/m3 pri 25 ° C. Jeho výpary sú 1,1 -násobne husté ako vzduch, zatiaľ čo jeho kvapalina alebo kondenzát je asi 0,89 -krát menej hustý ako voda.
Tlak vodnej pary
Pri teplote miestnosti sa váš tlak pary pohybuje 3,5 atm.
Dipolárny moment
1,31 d
Rozpustnosť
1.080 g/l pri 20 ° C. Je to plyn, ktorý sa veľmi dobre rozpúšťa vo vode, pretože obe molekuly sú polárne a pri zakladaní vodíkových mostov (ch3Hnh-oh2).
Základnosť
Metilamín má konštantu základnej príslušnosti (PKb) 3,36. Táto hodnota naznačuje, že ide o značne základnú látku, dokonca viac ako rovnaký amoniak, takže sa rozpustí vo vode, uvoľňuje určité množstvo OH iónov- Po hydrolyzizovaní:
Chvály3NH2 + H2Alebo ⇌ ch3NH3+ + Oh-
Metilamín je viac základný ako amoniak, pretože jeho atóm dusíka má väčšiu elektronickú hustotu. Je to preto, že Cho3 Urobené viac dusíkových elektrónov ako tri atómy vodíka v molekule NH3. Napriek tomu sa metyilamín považuje za slabú základňu pred ostatnými alkyamínmi alebo amínmi.
Môže vám slúžiť: Typ odkazu CO2Bod vzplanutia
-10 ° C na zatvorenú šálku, čo znamená, že je to vysoko horľavý a nebezpečný plyn.
Teplota
430 ° C
Povrchové napätie
19,15 Mn/m A 25 ° C
Rozklad
Keď horí, tepelne sa rozkladá v oxidoch uhlíka a dusíka, ktoré tvoria toxický dym.
Výroba
Metilamín môže byť vyrobený alebo syntetizovaný buď komerčnou alebo priemyselnou metódou alebo laboratórnymi metódami v dolných mierkach.
Priemyselný
Metilamín sa vyskytuje priemyselne prostredníctvom reakcie, ktorá sa uskutočňuje medzi amoniakom a metanolom na katalytickej sympatickej gélovej podpore. Chemická rovnica pre túto reakciu je nasledovná:
Chvály3Oh + NH3 → CH3NH2 + H2Ani
V tomto procese je možné generovať ďalšie alkamíny; Avšak metyilamín je produkt, ktorý klinericky vyzerá obľúbenejšie.
Laboratórium
Na laboratórnej úrovni existuje niekoľko metód, ktoré umožňujú syntézu metylamínu v malom rozsahu. Jednou z nich je reakcia v silnom základnom médiu KOH, medzi acetamidom a brómom, počas ktorého sa generuje metylizokianát, CH3NCO, ktoré sa zase hydrolyzuje, aby sa stala metyláciou.
Metilamín sa môže skladovať ako tuhá látka, ak je neutralizovaná kyselinou chlorovodíkovou, takže sa tvorí formy soli hydrochloridu:
Chvály3NH2 + HCI → CH3NH2· HCl
Potom, metylamín hydrochlorid, tiež predstavovaný ako [CH3NH3] Cl, môže byť založený na bezpečnom mieste na získanie vodného roztoku so rozpusteným plynom:
[Ch3NH3] CL + NaOH → CH3NH2 + NaCl + H2Ani
Na druhej strane môže byť metylamín syntetizovaný aj z hexamínu (ch2)6N4, ktorý je priamo hydrolyzovaný kyselinou chlorovodíkovou:
Môže vám slúžiť: kryštalizácia(Ch2)6N4 + HCl + 6 h2O → 4 NH4Cl + 6 ch2Ani
Po sebe chlorid amónny reaguje s horúcim formaldehydom, aby spôsobil výpary metyilalamínu a kyseliny mravčej, HCOOH.
Metylamín sa môže získať aj znížením nitromettánu, ch3Nie2 s kovovým zinkom a kyselinou chlorovodíkovou.
Žiadosti
 Efedrín je liek, ktorý potrebuje metyilamín na komerčnú výrobu. Zdroj: Turkeyphant.
Efedrín je liek, ktorý potrebuje metyilamín na komerčnú výrobu. Zdroj: Turkeyphant. Metilamín je zlúčenina, ktorej použitie zvyčajne vytvára kontroverziu, pretože ide o látku používanú v syntéze narkotík, ako je metamfetamín. V skutočnosti je jej popularita spôsobená túžbou, aby ju protagonisti televízneho seriálu Breaking Bad museli dostať za každú cenu.
Táto zlúčenina sa tiež používa ako surovina na produkciu insekticídov, liekov, povrchovo aktívnych látok, výbušnín, farbív, fungicídov, prísad atď., Má teda silný svetový dopyt, okrem viacerých právnych obmedzení pre jeho akvizíciu.
Jeho obrovská chemická univerzálnosť je spôsobená jeho molekulami Cho3NH2 Je to dobré nukleofilné činidlo, spojené alebo koordinované so substrátmi väčšej molekulárnej hmoty v niekoľkých organických reakciách. Napríklad je to založené na syntéze efedrínu, kde Cho3NH2 Spája molekulu s následnou stratou h.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Metylamín. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Metylamín. Databáza pubchem., CID = 6329. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Dylan Matthews. (15. augusta 2013). Tu je to, čo sa „Breaking Bad“ dostane do poriadku a mýli sa o obchodnom priemysle. Získané z: Washingtonpost.com
- Prepchem. (2020). Príprava metylamínového hydrochloridu. Získané z: Prepchem.com

