Štruktúra dusičnanu zinku, vlastnosti, získanie, použitie

- 3588
- 716
- Adrián Fajnor
On dusičnan zinku Je to anorganická zlúčenina tvorená prvkami zinočnatého (Zn), dusíka (N) a kyslíka (O) (O). Stav oxidácie zinku je +2, stav dusíka je +5 a kyslík je -2.
Jeho chemický vzorec je Zn (nie3)2. Je to tuhý bezfarebný kryštalický, ktorý má tendenciu absorbovať vodu z prostredia. Môže sa získať ošetrením zinočnatého kovu zriedenou kyselinou dusičnou. Je to silne oxidačná zlúčenina.
 Fifr Zn dusičnan (nie3)2. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons.
Fifr Zn dusičnan (nie3)2. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons. Slúži ako urýchľovač organickej chémie a umožňuje vám získať zložené polyméry s vlastnosťami jazdy elektriny. Používa sa na vytvorenie vrstiev užitočných materiálov v elektronike.
Je súčasťou niektorých tekutých hnojív a určitých herbicídov s pomalou releasom. Pomoc pri príprave komplexných oxidov zlepšujúcich vašu hustotu a elektrickú vodivosť.
Úspešne sa testoval pri získavaní štruktúr, ktoré slúžia ako základ pre regeneráciu a rast kostného tkaniva, zlepšenie tohto procesu a vedie k antibakteriálnemu.
Aj keď to nie je palivo, môže urýchliť spaľovanie látok, ktoré sú, napríklad uhlie alebo organické materiály. Je to dráždivé pokožku, oči a sliznice a je veľmi toxický pre vodný život.
[TOC]
Štruktúra
Dusičnan zinočnatého je iónová zlúčenina. Má bivalentnú katión (Zn2+) a dva monovalentné anióny (nie3-). Anión dusičnanu je polyiatomický ión tvorený atómom dusíka v oxidačnom stave +5 pripojený k trom atómom kyslíka s Valenciou z -2.
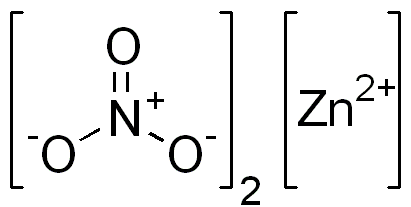 Štruktúra iónového dusičnanu zinku. EDGAR181 / Pub Doména. Zdroj: Wikimedia Commons.
Štruktúra iónového dusičnanu zinku. EDGAR181 / Pub Doména. Zdroj: Wikimedia Commons. Obrázok nižšie zobrazuje priestorovú štruktúru tejto zlúčeniny. Šedá centrálna guľa je zinok, modré gule sú dusík a červené gule predstavujú kyslík.
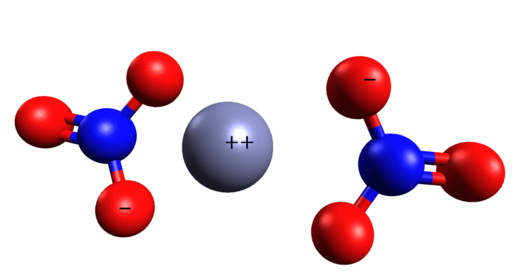 Priestorová štruktúra Zn (nie3)2. CINC je uprostred dusičnanov. Grasso Luigi/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Priestorová štruktúra Zn (nie3)2. CINC je uprostred dusičnanov. Grasso Luigi/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Menovanie
- Dusičnan cinc
- Zinkový dinitrát
Vlastnosti
Fyzický stav
Bezfarebná pevná alebo kryštalická biela.
Molekulová hmotnosť
189,40 g/mol
Bod topenia
Približne 110 ° C.
Môže vám slúžiť: Kyselina iahydrová (HI): Štruktúra, vlastnosti a použitiaBod varu
Približne 125 ° C.
Hustota
2 065 g/cm3
Rozpustnosť
Rozpustné vo vode: 120 g/100 g h2Alebo pri 25 ° C. Rozpustný alkohol.
pH
Jeho vodné roztoky sú kyslé. 5% roztok má pH približne 5.
Chemické vlastnosti
Za to, že je dusičnan, táto zlúčenina je silná oxidata. Násilne reaguje s uhlím, meďou, kovovými sulfidmi, organickými látkami, fosforom a síry. Ak sa postrieka na horúce uhlie, využíva.
Na druhej strane je hygroskopický a absorbuje vodu z prostredia. Ak forma oxidu zinočnatého, dusíka a oxid kyslíka:
2 Zn (nie3)2 + Teplo → 2 ZnO + 4 č2↑ + o2↑
V alkalických roztokoch, ako sú roztoky NaOH, zinok tejto zlúčeniny tvorí svoj hydroxid a ďalšie komplexné druhy:
Zn (nie3)2 + 2 oh- → Zn (OH)2 + 2 Nie3-
Zn (oh)2 + 2 oh- → [Zn (OH)4]2-
Získanie
Môže sa získať ošetrením zinočnatého alebo oxidu zinočnatého zriedenou kyselinou dusičnou. V tejto reakcii sa vytvára plynný vodík.
Zn + 2 hno3 → Zn (nie3)2 + H2↑
Žiadosti
Katalýza reakcií
Používa sa ako katalyzátor pri získavaní iných chemických zlúčenín, ako sú živice a polyméry. Je to kyslý katalyzátor.
 Príklad živice. Bugman v anglickej Wikipédii / verejnej doméne. Zdroj: Wikimedia Commons.
Príklad živice. Bugman v anglickej Wikipédii / verejnej doméne. Zdroj: Wikimedia Commons.  Model polymérnej štruktúry. Ilmari Karonen / Pub Doména. Zdroj: Wikimedia Commons.
Model polymérnej štruktúry. Ilmari Karonen / Pub Doména. Zdroj: Wikimedia Commons. Ďalším prípadom zrýchlenia reakcií je katalytický systém Zn (nie3)2/Vok2Ani4, čo umožňuje oxidáciu a-hydrolyster na a-zo-stresy s 99% konverziou aj pri environmentálnom tlaku a teplote.
V zložených polyméroch
Boli vyvinuté filmy polymetylmetakrylátu a Zn (nie3)2 s vlastnosťami elektrickej vodivosti, vďaka ktorým sú vhodnými kandidátmi, ktoré sa majú používať vo vysokohorských superkaugách a počítačoch.
V oxystových cementoch
S vodnými roztokmi dusičnanu zinku a práškom oxidu zinočnat.
Majú primeranú odolnosť voči rozpusteniu v zriedených kyselinách a alkaloch, pričom sa vyvíjajú kompresia kompresnej rezistencie v porovnaní s iným cementom.
Táto vlastnosť sa zvyšuje, keď sa zvýši pomer ZnO/Zn (nie3)2, A keď je nahraná koncentrácia Zn (nie3)2 V roztoku. Získané cementy sú úplne amorfné, to znamená, že nemajú kryštály.
Môže vám slúžiť: chemické zrážky Pri dusičnanom zinku sa vykonali testy na získanie cementov. Autor: KobthanApong. Zdroj: Pixabay.
Pri dusičnanom zinku sa vykonali testy na získanie cementov. Autor: KobthanApong. Zdroj: Pixabay. V povlakoch a nanomateriáloch oxidu zinočnatého
Zn (nie3)2 Používa sa na elektrolytické ukladanie veľmi tenkých vrstiev oxidu zinočnatého (ZnO) na rôznych substrátoch. Nanoštruktúry tohto oxidu sa tiež pripravujú na povrchoch.
 Nanočastice oxidu zinočnatého. Niektoré nanoštruktúry ZnO môžu byť pripravené na Zn (nie3)2. Verena Wilhelmi, Ute Fischer, Heike Wearcht, Klaus Schulze-Otthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC od (https: // creativeCommons.Org/licencie/BY/2.5). Zdroj: Wikimedia Commons.
Nanočastice oxidu zinočnatého. Niektoré nanoštruktúry ZnO môžu byť pripravené na Zn (nie3)2. Verena Wilhelmi, Ute Fischer, Heike Wearcht, Klaus Schulze-Otthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC od (https: // creativeCommons.Org/licencie/BY/2.5). Zdroj: Wikimedia Commons. ZnO je materiál, ktorý má veľký záujem z dôvodu množstva aplikácií v oblasti optolektroniky, má tiež polovodičové vlastnosti a používa sa v senzoroch a prevodníkoch.
Herbicídy
Dusičnan CINC sa používa spolu s niektorými organickými zlúčeninami na zníženie rýchlosti uvoľňovania určitých herbicídov vo vode. Pomalé uvoľňovanie týchto výrobkov umožňuje, aby boli k dispozícii dlhšie a menej aplikácií.
V anodovej výrobe
Stimuluje proces spekania a zlepšuje hustotu určitých oxidov, ktoré slúžia na výrobu anodov pre palivové články. Sinterovanie získava tuhý materiál prostredníctvom zahrievania a kompresie prášku bez toho, aby dosiahol jeho zlúčenie.
 Kreslenie, ako dochádza k spekaniu dvoch zŕn. Zn (nie3)2 Pomoc pri vykonávaní tohto procesu pri niektorých komplexných oxidoch. Doména CDang / Pub. Zdroj: Wikimedia Commons.
Kreslenie, ako dochádza k spekaniu dvoch zŕn. Zn (nie3)2 Pomoc pri vykonávaní tohto procesu pri niektorých komplexných oxidoch. Doména CDang / Pub. Zdroj: Wikimedia Commons. Materiály, v ktorých boli testy vykonané, sú komplexné oxidy stroncia, iridia, železa a titány. Prítomnosť FAL významne zvyšuje elektrickú vodivosť týchto.
Ostatné aplikácie
Používa sa pri získavaní liekov. Pôsobí ako mordant pri uplatňovaní atramentov a farbív. Slúži ako latexový koagulant. Je zdrojom zinku a dusíka v tekutých hnojivách.
Potenciálne použitie v inžinierstve kostného tkaniva
Táto zlúčenina sa používa ako prísada pri vypracovaní brnenia alebo rámcov na regeneráciu kostných vlákien, pretože umožňuje zlepšiť mechanický odpor týchto štruktúr.
Môže vám slúžiť: germanio: História, vlastnosti, štruktúra, získanie, použitieZistilo sa, že lešenie, ktoré obsahuje pätok, nie je toxické pre osteoprogenitorové bunky, podporuje aktivitu osteoblastov, ktoré sú bunkami, ktoré vyrábajú kosť a zlepšujú ich adhéziu a proliferáciu.
Uprednostňuje tvorbu apatity, ktorá je minerál, ktorý tvorí kosti a tiež uplatňuje antibakteriálny účinok.
 Zn (nie3)2 Mohlo by to byť veľmi užitočné pri rekonštrukcii kostnej hmoty u ľudí, ktorí utrpeli nehody. Mariano Coretti/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Zn (nie3)2 Mohlo by to byť veľmi užitočné pri rekonštrukcii kostnej hmoty u ľudí, ktorí utrpeli nehody. Mariano Coretti/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Riziká
Je to materiál s potenciálnym rizikom požiaru a výbuchu.
Nie je to palivo, ale zrýchľuje spaľovanie horľavých materiálov. Ak je veľké množstvo tejto zlúčeniny zapojené do požiaru alebo ak je horľavý materiál jemne rozdelený, môže dôjsť k výbuchu.
Ak sú vystavené silnému tepla, produkujú sa toxické oxidy dusíka. A ak sa expozícia vykonáva predĺžená, môže explodovať.
Je dráždivé pre pokožku, môže spôsobiť vážne poškodenie očí, podráždenie v dýchacích cestách, je toxický v dôsledku požitia a spôsobuje poškodenie tráviaceho traktu.
Veľmi toxický pre vodný život s účinkami, ktoré vydrží.
Odkazy
- Ju, a. a kol. (2019). Nový účinok dusičnanu zinočnatého/vanadylxalátu na selektívnu katalytickú oxidáciu alfa-hydroxylových esterov na alfa-keto esers s molekulárnym kyslíkom: in situ. Molekuly 2019, 24, 1281. MDPI sa zotavila.com.
- Mohd S., Siež.N. a kol. (2020). Formulácia kontrolovaného uvoľňovania dusičnanu hydroxidu zinočnatého interkalovaného s dodecylsulphe sodným a bispyribacmi: nový herbicídový nanokompozit na nelúpanú kultiváciu. Arabian Journal of Chemistry 13, 4513-4527 (2020). Zotavené z vedeckých pracovníkov.
- Človeče m.P. a kol. (2019). Obohatená mechanická pevnosť a mineralizácia kostnej mineralizácie elektrostatického biomimetického lešenia naloženého ylang ylang olejom a dusičnanom zinočnatého pre kostné tkanivové inžinierstvo. Polymers 2019, 11, 1323. MDPI sa zotavila.com.
- Kim, K.Jo. a kol. (2018). Účinky dusičnanu zinočnatého ako spekanej pomoci na elektochemické charakteristiky SR0,92A0,08Strýko3-delta a pán0,92A0,08Vy0,6Vernosť0,4Ani3-delta Ceramics International, 44 (4): 4262-4270 (2018). Zotavené z vedeckých pracovníkov.com.
- Prasad, b.A. a kol. (2012). Elektrodepozícia povlaku ZnO z vodného Zn (nie3)2 Kúpele: Vplyv koncentrácie Zn, ukladania teploty a času na orientáciu. J Solid State Electochem 16, 3715-3722 (2012). Odkaz obnovený.Prubár.com.
- Bahadur, h. a srivastava,.Klimatizovať. (2007). Morfológie sol-gel odvodené tenké filmy ZnO s použitím rôznych prekurzorových materiálov a ich nanoštruktúr. NanoScale Res Lett (2007) 2: 469-475. Odkaz obnovený.Prubár.com.
- Nicholson, J.W. a Tibaldi, J.P. (1992). Tvorba a vlastnosti cementu pripravené z oxidu zinočnatého a vodných roztokov dusičnanu zinku. J Mater Sci 27, 2420-2422 (1992). Odkaz obnovený.Prubár.com.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Maji, P. a kol. (2015). Účinok Zn (nie3)2 Výplň na dielektrickej demillite a elektrickom module PMMA. Bull Mater Sci 38, 417-424 (2015). Odkaz obnovený.Prubár.com.
- Alebo.Siež. Lekárska knižnica. (2019). Dusičnan zinku. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Byju's. (2020). Dusičnan zinku - Zn (NO3) 2. Uzdravený z Byjusa.com.
- Americké prvky. Dusičnan zinku. Zotavené z americalmentov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- « Štruktúra chloridu zinočnatého (ZNCL2), vlastnosti, získanie, použitia
- Konkrétne prípady etického konania v inštitúciách a organizáciách »

