Štruktúra chloridu zinočnatého (ZNCL2), vlastnosti, získanie, použitia

- 1261
- 241
- Valentín Dula
On chlorid zinku Je to anorganická zlúčenina tvorená prvkom zinku alebo zinku (Zn) a chlórom (Cl). Jeho chemický vzorec je ZnCl2. CINC sa nachádza v oxidačnom stave +2 a chlór má valenciu -1.
Je to bezfarebná alebo biela kryštalická pevná látka. Je veľmi rozpustný vo vode a ľahko ju absorbuje z prostredia, ktoré je možné vidieť na obrázku navlhčenej tuhej látky uvedenej nižšie.
 Chlorid fifcl2 Pevné trochu hydratované. Používateľ: Walkerma / verejná doména. Zdroj: Wikimedia Commons.
Chlorid fifcl2 Pevné trochu hydratované. Používateľ: Walkerma / verejná doména. Zdroj: Wikimedia Commons. Zinok tejto zlúčeniny je biologicky veľmi dôležitý pre ľudí, zvieratá a rastliny, pretože zasahuje do základných funkcií, ako je syntéza bielkovín a tuku.
Z tohto dôvodu ZnCl2 Používa sa ako výživový doplnok na zvieratá a ľudí v prípadoch nedostatku zinku a ako mikroživiny pre rastliny.
Má bakteriostatické a astringentné vlastnosti a je široko používaný na tieto účely v ľudskej aj veterinárnej medicíne. Tiež eliminuje škodcov, ako sú napríklad vonkajšie huby a je sprostredkovateľom, aby získali pesticídy.
Medzi jeho viacnásobné použitie slúži na ošetrenie celulózových a vlnených vlákien v rôznych procesoch, ako aj na ich prípravu na farbu alebo tlač. Tiež oneskorí spaľovanie dreva.
[TOC]
Štruktúra
Zncl2 Je to iónová zlúčenina tvorená katiónom Zn2+ a dva anióny chlorid cl- ktoré sa viažu cez elektrostatické sily.
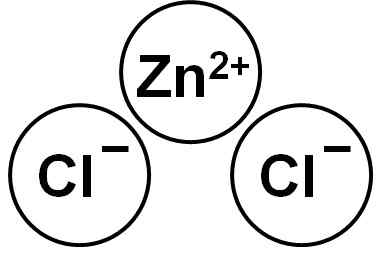 Chlorid zinku. Autor: Marilú Stea.
Chlorid zinku. Autor: Marilú Stea. Ión zinku (II) má nasledujúcu elektronickú štruktúru:
1s2, 2s2 2 P6, 3s2 3p6 3D10, 4s0,
v ktorom sa pozoruje, že oba elektróny mysu 4s, čím je konfigurácia stabilná.
Ión chloridu predstavuje nasledujúcu štruktúru:
1s2, 2s2, 2 P6, 3s2 3p6,
čo je tiež veľmi stabilné pre úplné orbitály.
Na obrázku je možné pozorovať spôsob, akým sú ióny dostupné v skle. Šedé gule predstavujú chlór zinok a zelené gule.
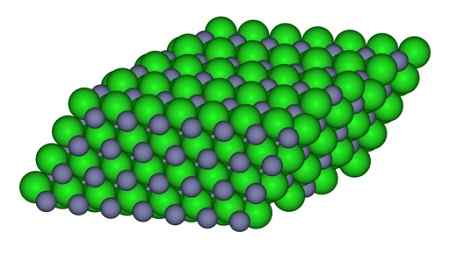 Štruktúra, ktorá tvorí ióny v kryštáli ZNCL2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Štruktúra, ktorá tvorí ióny v kryštáli ZNCL2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Menovanie
- Chlorid zinku (II)
- Dichlorid zinku
Vlastnosti
Fyzický stav
Bezfarebná pevná alebo kryštalická biela. Hexagonálne kryštály.
Molekulová hmotnosť
136,3 g/mol
Bod topenia
290 ° C
Bod varu
732 ° C
Hustota
2 907 g/cm3 pri 25 ° C
Rozpustnosť
Veľmi rozpustné vo vode: 432 g/100 g h2Alebo pri 25 ° C, 614 g/100 g h2Alebo 100 ° C. Veľmi rozpustné v kyseline chlorovodíkovej (HCL), alkoholu a glycerolu. Úplne miešateľný.
Môže vám slúžiť: Merkúrový hydroxid: Štruktúra, vlastnosti, použitie, rizikápH
Jeho vodné roztoky sú kyslé. Roztok 6 mólov ZnCL2/L má pH 1,0.
Chemické vlastnosti
Je to hygroskopická a delikástová zlúčenina, pretože v kontakte s vlhkosťou prostredia absorbuje veľa vody. Vo vode je hydrolyzovaný a má tendenciu tvoriť základný nerozpustný z oxychloridu zinočnatého.
Reaguje s oxidom zinočnatého (ZnO) vo vode vytvárajúcej oxychloridy zinku, ktoré tvoria mimoriadne tvrdý cementový materiál.
Je jemne korozívne voči kovom.
Nie je to horľavé.
Biologická úloha
Biologicky zinok je jedným z najdôležitejších prvkov. Bol uznávaný ako nevyhnutný pre všetky spôsoby života.
V ľudskom tele Zncl2 Zn poskytuje, čo je nevyhnutné pre syntézu bielkovín, cholesterolu a tuku. Obzvlášť CINC je dôležitá pre správne fungovanie imunitného systému.
 Zinok Zncl2 Je to dôležité pre bunkové delenie v živých bytostiach. Lamsyofhats / verejná doména. Zdroj: Wikimedia Commons.
Zinok Zncl2 Je to dôležité pre bunkové delenie v živých bytostiach. Lamsyofhats / verejná doména. Zdroj: Wikimedia Commons. Bolo identifikovaných viac ako 25 proteínov obsahujúcich zinok a mnohé z nich sú enzýmy potrebné v bunkovom delení a raste a na uvoľňovanie vitamínu A z pečene.
Nedostatok CINC môže viesť k rastu rastu, depresívnej mentálnej funkcii, anorexii, dermatitíde, zníženiu imunity, hnačky a zlé nočné videnie, okrem iného.
Získanie
Komerčne sa táto zlúčenina pripravuje reakciou vodnej kyseliny chlorovodíkovej so šrotom, odpadom zinku alebo minerálom, ktorý ho obsahuje. V tejto reakcii je tiež plynový vodík (H2).
Získa sa ošetrenie zinku chloridom vodíka pri 700 ° C.
Zn + HCl → ZnCl2 + H2↑
Žiadosti
Pri terapeutických ošetreniach
Je to mäkký alebo bakteriostatický antibakteriálny. Slúži tiež na liečbu kalusov ako s astringent a chemiocirugia pri rakovine kože.
Používa sa ako adstringent v niektorých kozmetike, ako sú osviežujúce pleťové vody pre pokožku.
Ako výživový doplnok
Kvôli jeho dôležitosti v rôznych funkciách ľudského organizmu ZnCL2 Podáva sa perorálne ako súčasť výživového príslušenstva a tiež u ľudí, ktorí potrebujú parenterálne jedlo.
Doplnky ZNCL2 Sú dodávané na ošetrenie zóny.
Môže vám slúžiť: homogénna zmes Doplnky ZNCL2 Mali by sa používať, keď existuje nedostatok zinku. Autor: Moakets. Zdroj: Pixabay.
Doplnky ZNCL2 Mali by sa používať, keď existuje nedostatok zinku. Autor: Moakets. Zdroj: Pixabay. Zdraví jednotlivci ho získavajú prostredníctvom potravín.
Malo by sa dodávať najmenej 1 hodinu pred jedlom alebo 2 hodiny po nich, pretože niektoré potraviny môžu zabrániť ich absorpcii. U pacientov, ktorí majú podráždenie žalúdka po doplňovaní požitia, by ho malo požičať jedlom, ale týmto spôsobom bude zinok menej biodisponiteľný.
Vo veterinárnych aplikáciách
Jeho roztoky sa používajú u zvierat ako žieravé látky na spaľovanie alebo fistuly z kaulky, ktoré sú spojeniami medzi orgánmi, ktoré nie sú normálne alebo zdravé; Vo forme cestovín slúži na liečbu vredov a chemoterapie rakoviny.
 Vodné roztoky ZnCl2 Používajú sa na liečbu infekcií zvierat. Autor: Mabel Amber. Zdroj: Pixabay.
Vodné roztoky ZnCl2 Používajú sa na liečbu infekcií zvierat. Autor: Mabel Amber. Zdroj: Pixabay. Pri očných infekciách pôsobí veľmi zriedený roztok tejto zlúčeniny ako antiseptický a sviatočný.
Používa sa tiež ako stopy v krmive pre zvieratá alebo ako doplnok potravín.
V špeciálnych cementoch
Reakcia medzi ZnCL2 A ZnO vo vode produkuje nejaký zinkový oxychlorid, ktorý tvorí extrémne tvrdý alebo cementový materiál. Hlavné zložky sú 4zno • Zncl2• 5h2O a ZnO • Zncl2• 2h2Ani.
Tento typ cementov odoláva útoku kyseliny alebo vriacej vody. Pentahydrát je však veľmi stabilný a nerozpustný, ale nemenný a dihydrát je rozpustnejší a môže spôsobiť tekutý odtok.
Z týchto dôvodov majú tieto cementy málo aplikácií.
Ako katalyzátor
Slúži na urýchlenie niektorých reakcií organickej chémie. Pôsobí ako kondenzátorový agent. Napríklad pri aldolických reakciách, aminačných reakciách a reakciách na pridávanie cyklu. V niektorých z týchto pôsobí ako radikálny iniciátor.
Je to Lewisová kyselina a katalyzuje Dield-Alder Reactions. Používa sa tiež ako katalyzátor pri reakciách Friedel-Crafts, na výrobu farbív a farbív a pri výrobe polyesterovo-politických živíc.
Nižšie je reakcia, v ktorej táto zlúčenina zasahuje:
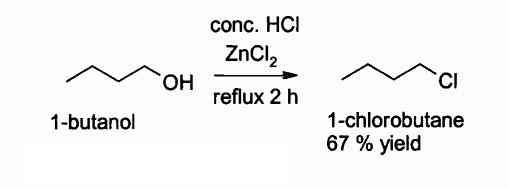 Reakcia získania alkylchloridu pomocou ZNCL2. Autor: Walkerma. Zdroj: Wikimedia Commons.
Reakcia získania alkylchloridu pomocou ZNCL2. Autor: Walkerma. Zdroj: Wikimedia Commons. V poľnohospodárskych činnostiach
Používa sa ako herbicíd v plodinách, ako ošetrenie listom, na odstránenie škodcov, ako sú huby a mach a ako mikroživina. Je sprostredkovateľom prípravy pesticídov.
V zubných aplikáciách
Používa sa v ústach, avšak odporúčaný kontaktný čas je veľmi krátky, takže pôsobí iba ako adstringent v ústnej sliznici. Slúži ako desenzibilizátor, používa sa v denníkových pastoch a je súčasťou zubných cementov.
Môže vám slúžiť: chlorit sodný (NACLO2): Štruktúra, vlastnosti, použitia, rizikáV textilnom a papierovom priemysle
Je to zložka rozpúšťadla, ktorá sa používa pri výrobe rayónu alebo umelého hodvábu z celulózy. Je to retikulácia alebo agent Únie pre živice, ktoré dokončujú textily. Slúži tiež na to, aby sa k nim zaobchádzalo a uprednostňovalo ich ochranu.
Umožňuje zvrhnúť látky, oddeliť hodvábne a vlnené vlákna a pôsobí ako mordant v tlači a sfarbenie textilu.
Používa sa pri výrobe papierových zvitkov a na výrobu krepového papiera.
Pri príprave nanočastíc
Reakciou chloridu zinočnatého sulfidom sodným (NA2S) prostredníctvom sonochemickej metódy a v prítomnosti určitých organických zlúčenín sa získajú nanočastice sulfidu zinočnatého (ZNS). Sonochemické metódy používajú zvukové vlny na spôsobenie chemických reakcií.
Tento typ nanomateriálov by sa mohol uplatniť ako fotokatalytické činidlá na výrobu, napríklad delenie vody v jej zložkách (vodík a kyslík) pôsobením svetla.
V niekoľkých aplikáciách
- Dezodorant, antiseptické a dezinfekčné oblasti oblastí. Moss, plesne a huby ovládanie vonkajších susedných štruktúr a oblastí, ako sú chodníky, nádvoria a ploty. Dezinfekčný prostriedok toalety, moču, kobercov a stlačené drevo.
- Používa sa v zmesiach pre embalmar a roztoky na zachovanie anatomických vzoriek.
- Retardér dreva.
- Primárna zložka v dymových čerpadlách používaných na rozptýlenie množstva ľudí; Hasiči ich používajú pri požiarnych bojových cvičeniach a praktikách.
 Chlorid CINC sa používa v dymových čerpadlách používaných vo vojenských cvičeniach. Alebo.Siež. Oddelenie obrany súčasný Photosppl. Abraham Lopez / 2. námorná divízia / verejná doména. Zdroj: Wikimedia Commons.
Chlorid CINC sa používa v dymových čerpadlách používaných vo vojenských cvičeniach. Alebo.Siež. Oddelenie obrany súčasný Photosppl. Abraham Lopez / 2. námorná divízia / verejná doména. Zdroj: Wikimedia Commons. - Zváracia zložka. V kovovej nahrávke. Pre oceľové sfarbenie, galvanizovaná a železná dýha kúpeľňa s meďou.
- V cementách horčíka a kovového cementu.
- Prelomiť emulzie v rafinácii ropy. Agent vo výrobe asfaltu.
- Elektrolyt v sušených batériách.
 Suchá zncl batéria2. Používateľ: 32bitmaschine; Editoval používateľom Jaybear/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Suchá zncl batéria2. Používateľ: 32bitmaschine; Editoval používateľom Jaybear/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. - Vulkanizácia gumy.
- Dehydratačný agent.
Riziká
Môže spôsobiť popáleniny očí, pokožky a sliznice.
Keď sa zahrieva na jeho rozklad emituje toxický chlorid vodíka (HCI) a oxid zinočnatý (ZNO).
Varovanie o jeho užívaní ako drogy
Aj keď chýbajú presvedčivé štúdie, odhaduje sa, že ak sa táto zlúčenina podáva tehotným ženám, môže to spôsobiť poškodenie plodu. Potenciálne výhody by však mohli mať väčšiu váhu, ako je možné, riziká.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Chlorid zinok. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Liska, m. a kol. (2019). Špeciálny cement. Zinkový oxychlorid cement. V Lea's Chemistry of Cement and Concret (piate vydanie). Zotavené z vedeckých pracovníkov.
- Pohanish, r.P. (2017). Chlorid zinok. V Sittigovej príručke toxických a nebezpečných chemikálií a karcinagenov (siedme vydanie). Zotavené z vedeckých pracovníkov.com.
- Gedanken, a. a perelshtein, i. (2015). Výkonový ultrazvuk na výrobu nanomateriálov. Ultrazvuk. Zotavené z vedeckých pracovníkov.
- Archibald, s.J. (2003). Skupiny prechodných kovov 9-12. Reakcie a katalýza. V porozumení koordinačnej chémie II. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- « Štruktúra chromátu zinku, vlastnosti, získanie, použitie
- Štruktúra dusičnanu zinku, vlastnosti, získanie, použitie »

