Štruktúra dusičnanu olovo, vlastnosti, získanie, použitia

- 1472
- 53
- JUDr. Rudolf Čapkovič
On dusičnan o Dusičnan olovo (II) je anorganická zlúčenina tvorená olovenými prvkami (PB), dusík (N) a kyslík (O). Olovo sa nachádza ako ión PB2+ A dusík a kyslík tvoria dusičnanový ión3-.
Jeho chemický vzorec je PB (nie3)2. Je to biela kryštalická tuhá látka veľmi rozpustná vo vode, kde tvorí ióny PB2+ a nie3-. Je tiež známy ako inštalatérsky dusičnan, pretože olovo je v jeho najnižšom oxidačnom stave.
 Pevný dusičnan. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons.
Pevný dusičnan. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons. Má silne oxidačné vlastnosti, takže sa používa v aplikáciách, v ktorých je potrebná táto charakteristika, napríklad pri príprave rôznych organických zlúčenín a ako laboratórneho činidla.
V minulosti sa široko používa na prípravu farieb založených na olova, kde pôsobil aj ako fixér farieb v tkanivách. Táto aplikácia bola opustená kvôli vedúcej toxicite.
Používa sa v metalurgickom priemysle rôznymi spôsobmi a nedávno sa zistilo, že jeho užitočnosť sa vytvára spolu s inými zlúčeninami, materiály s vysokou absorpčnou kapacitou svetla a transformáciou tohto v elektrine.
Je to však nebezpečná látka, pretože môže uprednostňovať generovanie požiaru. Je to tiež toxické pre človeka, zvieratá a rastliny, takže by sa v prostredí nikdy nemalo vyradiť.
[TOC]
Štruktúra
Je to iónová zlúčenina tvorená katiónom PB2+ a dva anióny nie3-. V dusičnanom aniónovom kyslíku je usporiadaný symetricky okolo dusíka a s týmto striedam dvojitú väzbu.
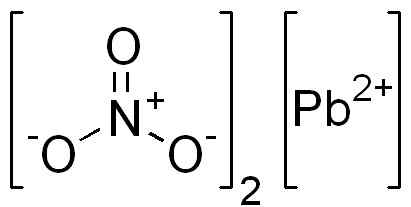 Štruktúra PB (nie3)2. EDGAR181 / Pub Doména. Zdroj: Wikimedia Commons.
Štruktúra PB (nie3)2. EDGAR181 / Pub Doména. Zdroj: Wikimedia Commons. 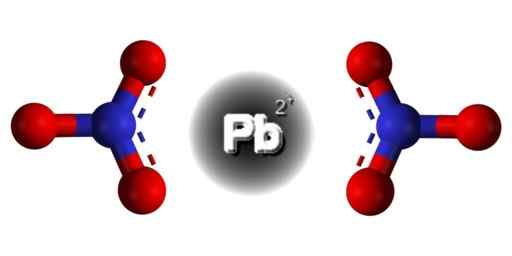 Priestorová štruktúra PB (nie3)2. Gray = olovo; modrá = dusík; Červená = kyslík. Claudio Pistilli/CC By-S (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Priestorová štruktúra PB (nie3)2. Gray = olovo; modrá = dusík; Červená = kyslík. Claudio Pistilli/CC By-S (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Olovo v tejto zlúčenine má nasledujúcu elektronickú konfiguráciu:
[Xe] 4F14 5d10 6siež2 6p0, kde sa zistí, že stratil 2 elektróny poslednej vrstvy.
Môže vám slúžiť: aký je najviac elektronegatívny prvok a prečo?Menovanie
- Dusičnan
- Dusičnan (II)
- Plumboso dusičnan
- Dinitrát
Vlastnosti
Fyzický stav
Biela alebo bezfarebná kryštalická pevná látka. Kubické kryštály.
Molekulová hmotnosť
331 g/mol
Bod topenia
470 ° C. Podľa niektorých zdrojov sa pri tejto teplote rozkladá.
Hustota
4,53 g/cm3
Rozpustnosť
Veľmi rozpustné vo vode: 59,7 g/100 ml vody pri 25 ° C. Mierne rozpustný v etanole. Nerozpustný v kyseline dusičnej (HNO3) koncentrovaný.
pH
Vodný roztok s 20% PB (nie3)2 Má pH 3,0-4.0.
Chemické vlastnosti
Je oxidačné činidlo. Násilne reaguje s horľavými materiálmi a reduktormi.
Nie je to palivo, ale môže urýchliť spaľovanie materiálov, ktoré sú. Ak sa zahrievate na jeho rozklad emituje toxické plyny oxidu dusíka:
2 pb (nie3)2 + Teplo → 2 pbo + 4 č2↑ + o2↑
Pri rozpustení vo vode je ionizovaný:
PB (nie3)2 + H2O → pb2+ + 2 Nie3-
Získanie
Môže sa pripraviť reagovaním kovového olova, oxidu olova (PBO) alebo uhličitanu olova3 S kyselinou dusičnou. Je vhodné použiť prebytok kyseliny na zabránenie základných dusičnanov.
PBO + 2 HNO3 (koncentrované) → Pb (nie3)2↓+ h2Ani
Žiadosti
Organický
Jeho oxidačná kapacita má aplikáciu pri príprave rôznych zlúčenín.
Používa sa na syntézu kalixarenos, ktoré sú organickými zlúčeninami, ktorých molekula má tvar koša, ktorý umožňuje umiestniť ďalšie látky v závislosti od použitia, ktoré sa mu dajú.
Slúži na získanie izotiociatátov (R-CS) od amínov (R-NH2).
Používa sa v priemyselnom meradle na prípravu benzaldehydu oxidazačného chloridu benchílu. Slúži tiež ako katalyzátor pre esterifikáciu organických zlúčenín, napríklad pri získavaní polyestrov.
V chemickej analýze
Používa sa ako činidlo pri určovaní hliníka a olova v mineráloch a skalách.
V sfarbení textilných vlákien
Niektoré chrómové farbivá vyžadujú použitie PB (nie3)2 získať. Napríklad na farbenie bavlny žltej je pokrytá oloveným dusičnanom a je ošetrená síranom sodným za výrobu sulfátu olova.
Môže vám slúžiť: rovnocenná váhaPotom sa na vytvorenie chromátu olovo používa zriedený roztok dichromátu sodného (PBCRO4) To je žltý pigment.
 Pred časom boli žlté tkaniny zafarbené pigmentmi, ktorých východiskovým bodom bol PB (nie3)2. To sa nerobí pomocou olovnej toxicity. Autor: 3D Animation Production Company. Zdroj: Pixabay.
Pred časom boli žlté tkaniny zafarbené pigmentmi, ktorých východiskovým bodom bol PB (nie3)2. To sa nerobí pomocou olovnej toxicity. Autor: 3D Animation Production Company. Zdroj: Pixabay. Dnes sa však prestali používať olovené pigmenty pre ich toxicitu.
Pôsobí tiež ako mordant, aby opravil farbivá počas farby alebo tlače iných typov vlákien.
V Medine Veterinary
Pri liečbe Chancros alebo Gangrenas u koní sa predtým používalo ako žieravé činidlo.
V kovovom priemysle
Dusičnan olovo sa používa pri elektrolytickej rafinácii olova, ako činidlo na uprednostňovanie flotácie pri odstraňovaní titánu určitých ílov, umožňuje obnoviť drahé kovy roztokov kyanidov a používa sa v elektróde PBO2 v niklovom anóde.
V solárnych článkoch
Používa sa vo forme vodného roztoku na výrobu solárnych článkov na základe Perovskita, minerálu oxidu titánu.
Syntetizovaný materiál je organometalická alebo pervskita olovo jodidu, ktorá upútala pozornosť vedcov, pretože má vysokú absorpčnú kapacitu svetla a veľkú difúznu dĺžku nosičov záťaže.
Vďaka týmto charakteristikám je vynikajúcim kandidátom na fotovoltaické zariadenia, to znamená, že svetlo na elektrický prúd.
 Mikrofotografia štruktúry Unavskita halogenidu olovo odobrala fluorescenčným mikroskopom. Furava/cc od (https: // creativeCommons.Org/licencie/o/4.0). Zdroj: Wikimedia Commons.
Mikrofotografia štruktúry Unavskita halogenidu olovo odobrala fluorescenčným mikroskopom. Furava/cc od (https: // creativeCommons.Org/licencie/o/4.0). Zdroj: Wikimedia Commons. Ostatné aplikácie
On (pbno3)2 Bola tiež použitá:
- Pri výrobe zápasov, určité výbušniny a pyrotechnické materiály,
- Vo fotografii ako senzibilizačného činidla na pokrytie papiera vo fototermografii,
- V textilnom priemysle na zlepšenie rayónu a stabilizáciu nylonu,
- Pri odstraňovaní hlodavcov.
 Dusičnan olovo sa používa na výrobu ohňostroja alebo pyrotechnického materiálu. Autor: Free Goos. Zdroj: Pixabay.
Dusičnan olovo sa používa na výrobu ohňostroja alebo pyrotechnického materiálu. Autor: Free Goos. Zdroj: Pixabay. Riziká
Oheň a výbuch
Aj keď to nie je zlúčenina z paliva, ak je vystavená požiaru alebo ohrievaniu, môže explodovať, vytvára toxický oxidy dusíka.
Byť silne oxidačným činidlom existuje nebezpečenstvo, že sa generuje oheň, ak príde do kontaktu s organickými materiálmi.
Do zdravia
Vytvára podráždenie očí, dýchacie a tráviace trakty. Je toxický inhaláciou a požitím. Najbežnejšími príznakmi otravy touto zlúčeninou sú gastrointestinálne, kolika, zápcha a slabosť, ktorá sa môže medzi iným stať paralýzou niektorých svalov.
Jeho požitie môže tiež spôsobiť bolesť, kŕče, depresiu, kómu a smrť.
Pre prírodné prostredie
Je toxický pre vodné a pozemné organizmy, navyše ich škody sú pretrvávajúce a bioakumula u živých bytostí, preto sa považuje za nebezpečnú znečisťujúcu látku a nemala by sa vyradiť do životného prostredia.
Ak sa náhodou vylieva do vody, mala by byť neutralizovaná oxidom vápenatého (CAO), uhličitanom vápenatého (CACO3) alebo hydrogenuhličitan sodný (NAHCO3).
Potvrdilo sa, že je to karcinogén pre zvieratá a prípadne pre človeka.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Olovo (ii) dusičnan. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Hsih, t.A. a kol. (2015). Účinný solárny článok POSVSKIT vyrobený pomocou prekurzora vodného oloveného dusičnanu. Chem Commun (zmena). 2015, 4. septembra; 51 (68): 13294-7. NCBI sa zotavila.NLM.NIH.Vláda.
- Vratny, f. a Gugliotta, f. (1963). Tematický rozklad dusičnanu. J. Inorg. Nucl. Chem., 1963, zv. 25, pp. 1129-1132. Zotavené z vedeckých pracovníkov.com.
- Chakraborty, J.N. (2014). Farbenie s minerálnymi farbami. Vo fondoch a postupoch vo farbe textilu. Zotavené z vedeckých pracovníkov.com.
- Kumari, h. a Atwood, J. (2017). Kalixarény v pevnom stave. V referenčnom modulácii v chémii, molekulárnych vedách a chemickom inžinierstve. Zotavené z vedeckých pracovníkov.com.
- Jeffery, P.G. a Hutchison, D. (1981). Hliník. V chemických metódach analýzy hornín (tretie vydanie). Zotavené z vedeckých pracovníkov.com
- Sandler, s.R. a Karo, w. (1992). Kyanátes, izokyanáty, tiokyanáty a izotiokyanáty. V zdroji pokročilých organických laboratórnych prípravkov. Zotavené z vedeckých pracovníkov.com.
- Smith, P.W.G. a kol. (1969). Aromatické halogénové zlúčeniny. V aromatickej chémii. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Nadácia Wikimedia (2020). Olovo (ii) dusičnan. Získaný z.Wikipedia.orgán.
- Shinde, D.Vložka. a kol. (2017). Zvýšená efektívna a stabilita vodného organometového slnečného bunky na báze vodného dusičnanu. Appl. Mater. Rozhrania 2017, 9, 14023-14030. Získané z krčiem.ACS.orgán.
- « Fenoly alebo fenolové zlúčeniny Vlastnosti, typy, aplikácie
- Štruktúra octanu, vlastnosti, získanie, použitie, použitia »

