Fenoly alebo fenolové zlúčeniny Vlastnosti, typy, aplikácie

- 1140
- 45
- Tomáš Klapka
Ten Fenoly Sú to rodina organických zlúčenín (alkoholov), ktoré sa vyznačujú aromatickým kruhom, v ktorom je jeden alebo viac atómov vodíka spojené s atómami uhlíka kruhu nahradený jednou alebo viacerými hydroxylovými skupinami (-OH).
Fenoly a ich deriváty sú zvyčajne prítomné v prírode, pretože ako organické molekuly vyrábajú prakticky všetky živé bytosti.
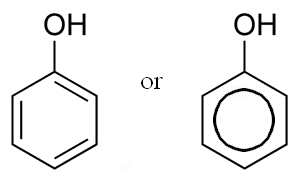 Chemická štruktúra fenolu, najjednoduchšia fenolová zlúčenina (zdroj: Dbenbenn, cez Wikimedia Common)
Chemická štruktúra fenolu, najjednoduchšia fenolová zlúčenina (zdroj: Dbenbenn, cez Wikimedia Common) Medzi najbežnejšie príklady fenolov môžeme spomenúť aminokyselinový tyrozín, jeden z 20 proteínových aminokyselín, ktorý má ako svoju substituentnú skupinu fenolový kruh; Majú tiež fenolové skupiny adrenalín a serotonín, dva veľmi dôležité hormóny pre cicavcové zvieratá.
Rastliny sú „učitelia“ vo výrobe fenolových zlúčenín, pretože mnohé zo svojich sekundárnych metabolitov (základné pre ich rast, reprodukciu, ochranu atď.) Majú vo svojich štruktúrach jednu alebo viac z týchto chemických skupín, ktoré zvyčajne pochádzajú z metabolických trás, ako je penóza fosforečnanu, šikimato a fenylpropanoidy.
 Štruktúra tyrozínu aminokyseliny, ktorej skupina R je fenolický kruh (benzén + OH) (zdroj: Neurotokeker, cez Wikimedia Commons)
Štruktúra tyrozínu aminokyseliny, ktorej skupina R je fenolický kruh (benzén + OH) (zdroj: Neurotokeker, cez Wikimedia Commons) Fenoly boli široko študované kvôli charakteristikám, ktoré vykazujú tvárou v tvár oxidačnému stresu (ako sú antioxidanty) u ľudí, najmä u tých, ktorí trpia metabolickými patológiami, ako je obezita, cukrovka alebo nejaký kardiovaskulárny stav.
S týmito antioxidačnými vlastnosťami vyniká a-tokoferol, fenolová derivátová zložka vitamínu E, ktorá je prítomná v krvnej plazme a je schopná „chytiť“ voľné peroxidové radikály, ktoré sú potenciálne škodlivé pre bunky pre bunky pre bunky.
Okrem toho sa v antropogénnom kontexte ľudská bytosť „naučila“ využívať vlastnosti fenolových zlúčenín z priemyselného hľadiska na výrobu farbív, polymérov, liekov a iných organických látok so širokou škálou rôznych použití a vlastností , hoci bohužiaľ mnohé z nich predstavujú dôležité zdroje znečistenia životného prostredia.
[TOC]
Vlastnosti fenolov
Fenolové zlúčeniny majú veľkú diverzitu fyzikálno -chemických vlastností, ktoré priamo súvisia s ich prospešnými vlastnosťami pre zvieracie a rastlinné bunky.
Hydroxylové skupiny fenolov určujú ich kyslosť, zatiaľ čo ich bennický kruh (aromatický kruh) určuje jeho základnosť. Z fyzikálno -chemického hľadiska môžeme povedať, že fenoly:
- Sú to zlúčeniny s nízkym bodom topenia.
- Rovnako ako akýkoľvek iný alkohol, fenoly majú hydroxylové skupiny schopné zúčastňovať sa na intermolekulárnych vodíkových väzbách (vodíkové mosty), ešte silnejšie ako tie, ktoré môžu vytvárať iné alkoholy.
- Pri kryštalizácii tieto zlúčeniny tvoria určitý druh kryštálov ako bezfarebné „hranoly“, ktoré majú charakteristickú prenikajúcu vôňu.
Môže vám slúžiť: ovalbumín: štruktúra, funkcie, denaturácia- Pri topení tvoria fenoly kryštalické „mobilné“ tekutiny (bezfarebné).
- Vďaka skutočnosti, že môžu tvoriť vodíkové mosty, môžu byť tieto zlúčeniny veľmi rozpustné vo vode, čo závisí od teploty a všeobecných charakteristík ostatných skupín, s ktorými sú spojené.
- Rýchlo sa rozpustia vo väčšine organických rozpúšťadiel, najmä u tých, ktorých zloženie pozostáva z aromatických uhľovodíkov, alkoholov, ketónov, éterov, kyselín, halogénovaných uhľovodíkov atď. (ktorý tiež závisí od všeobecnej štruktúry molekuly, v ktorej sú umiestnené fenolové skupiny).
- Majú bod mrazu asi 40 ° C.
- Jeho molekulová hmotnosť sa pohybuje medzi 94 a 100 g/mol.
Bunky
Pokiaľ ide o bunky, na druhej strane, fenolové zlúčeniny sa vyznačujú:
- Buďte antioxidačnými zlúčeninami, pretože majú redukčné vlastnosti, ktoré fungujú ako „darcovia“ činidiel vodíka alebo elektrónov (pôsobia ako „únosy“ voľných radikálov).
- Byť chelary kovových iónov, najmä železa a meď, potlačujúc tvorbu voľných radikálov katalyzovaných kovmi.
- Majú antimikrobiálnu aktivitu, pretože sú schopné oddialiť inváziu mikróbov a zabrániť hnilobe a zeleninovej hnilobe (takže sú tiež priemyselne využívané).
Klasifikácia: Typy fenolov
V závislosti od kontextu je možné fenoly klasifikovať rôznymi spôsobmi, ale najpoužívanejšia chemická klasifikácia je založená na počte hydroxylových skupín (-OH), ktoré sa viažu na rovnaký aromatický kruh (nahradenie atómu vodíka). V tomto zmysle boli definované:
- Fenoly monohydrický, S jednou hydroxylovou skupinou
- Fenoly Dihydries, S dvoma hydroxylovými skupinami
- Fenoly trihydrický, S tromi hydroxylovými skupinami
- Fenoly Polyhydrický, S viac ako tromi hydroxylovými skupinami
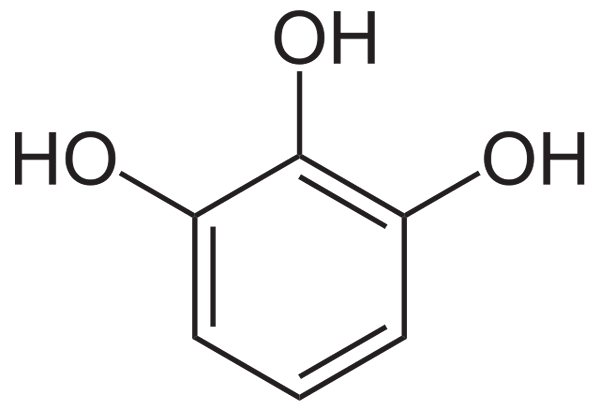 Pyrogalol (Trihydroxyfenol), fenolová zlúčenina bežne používaná na výrobu kapilárnych farbív, ako antiseptikum a ako „vývojár“ v vývojárov bielych Negro (zdroj: Neurotoger / verejná doména prostredníctvom Wikimedia Commons prostredníctvom Wikimedia)
Pyrogalol (Trihydroxyfenol), fenolová zlúčenina bežne používaná na výrobu kapilárnych farbív, ako antiseptikum a ako „vývojár“ v vývojárov bielych Negro (zdroj: Neurotoger / verejná doména prostredníctvom Wikimedia Commons prostredníctvom Wikimedia) Tieto organické zlúčeniny môžu byť jednoduché fenolové molekuly alebo polymerizované zlúčeniny s veľkou zložitosťou a ukázalo sa, že väčšina fenolov nachádzajúcich sa v prírode sa vyskytuje ako mono-a polysacharidové konjugáty esterov a metylesterov.
Je potrebné poznamenať, že iné klasifikácie súvisia aj s „nefenolovou časťou“ zlúčenín, ale to vo veľkej miere závisí od zdroja získania (prírodné alebo umelé).
Extrakčné metódy
Fenoly objavil v roku 1834 Friedlieb Runge, ktorý izoloval fenol (Najjednoduchšia fenolová zlúčenina) zo vzoriek minerálneho dechtu a nazýva sa ju „kyselina karbolová“ alebo „kyselina“ uhoľný olej. Čistý fenol však pripravil Auguste Laurent o niekoľko rokov neskôr, v roku 1841.
Môže vám slúžiť: Organogenéza zvierat a rastlín a jej vlastnostiV súčasnosti sú malé množstvá fenolu stále izolované z rastlín Tarry a Coke (rastliny praskanie). Mnoho syntetických metód používaných v minulosti aj dnes zahŕňa syntézu fenolu z benzénu ako prekurzorového kruhu, napriek tomu, že ide o mimoriadne prchavú a karcinogénnu zlúčeninu.
Syntéza týchto zlúčenín z benzénu môže byť jemná hydrolýzou chlórbenzénu alebo oxidáciou izopropylbenzénu (cumeno).
- Ťažba
Veľké množstvo fenolových zlúčenín prírodného pôvodu sa extrahuje z prípravkov z rôznych častí anatómie zeleniny. Bohužiaľ neexistujú žiadne štandardizované protokoly na tento účel, pretože veľa závisí od účelu extrakcie, typu tkaniva, konkrétnej triedy fenolu, okrem iného.
príprava vzorky
Vzorky sa všeobecne predtým pripravujú technikami, ako je sušenie alebo dehydratácia, rozdrvené, homogenizácia alebo filtrácia.
Musí sa brať do úvahy, že pri extrakcii fenolov vzoriek rastlín sa skutočne získa komplexná zmes fenolových zlúčenín rôznych tried, najmä tie, ktoré majú vlastnosti, ktoré ich robia rozpustnejšími v rozpúšťadlách používaných na tento účel.
Extrakcia
Extrakcia, akonáhle sa vzorky získajú a sú pripravené na tento účel, sa zvyčajne vykonáva inkubáciou vzoriek získaných v organických rozpúšťadlách, kde sa organická fáza často čistí metódami, ako je extrakcia v tuhej fáze, stĺpcová chromatografia a protiprúdová chromatografia.
Okrem extrakcie rozpúšťadla, ďalšie techniky zahŕňajú použitie ultrazvuku, mikrovlnnej alebo predpokladanej a superkritickej kvapaliny.
Aplikácie fenolov
Fenoly majú viac aplikácií, a to tak, ktoré sú izolované od živých organizmov, ako aj od umelo syntetizovaných.
Pri výrobe potravín
Potravinový priemysel používa mnoho fenolových zlúčenín na „opevnenie“ výrobkov, zvyšovanie polovice života niektorých potravín a dokonca aj súčasťou ich aktívnych výživových zlúčenín.
Hlavným dôvodom, prečo sú také užitočné, je to, že sa ukázali ako dobré „biologické tlak“ pre potraviny, ktoré sa podliehajú, a okrem toho umožňujú výrobu potravín bez potreby používať syntetické prísady, ktoré môžu mať negatívny vplyv na zdravie spotrebiteľov.
Priemyselné aplikácie niektorých syntetických fenolov
Fenol, ktorý je jednou z najjednoduchších fenolických zlúčenín a najnepneávanejšie, sa získa z minerálnych dechtov a niektorých syntetických metód a bežne sa používa na výrobu:
Môže vám slúžiť: primárny vývar alebo primitívna polievka- Nájomné (pre herbicídy a plasty)
- Cresoly (pre rozpúšťadlá)
- Xilenoles (na výrobu antioxidantov a redoxných ukazovateľov)
- fenolové živice
- Anilíny (na výrobu polyuretánu, obrazov, herbicídov, lakov atď.)
- Textilné farbivá
- Výbušniny
- Pesticídy atď.
Chlorofenoly, ktoré sú najväčšou skupinou fenolov, sa používajú na syntézu dezinfekčných prostriedkov, herbicídov a pesticídov. Tieto vedú zoznam znečisťujúcich látok, vodných a poľnohospodárskych výrobkov.
Použitie niektorých prírodných fenolov
Mnoho fenolových zlúčenín prírodného pôvodu sú dennými zamestnancami vo farmaceutickom a lekárskom priemysle na liečbu a prevenciu patológií, ako je rakovina. Tieto zlúčeniny sú izolované z bylín a liečivých rastlín a obsahujú sériu fenolových kyselín, flavonoidov, tanínov, kurcuminoidov, lignanov, chinónov atď.
Mnohé z týchto zlúčenín sú aktívne, ako sú antioxidanty, anti -karcinogénne, antimutagénne a dokonca anti -efekty.
Ukázalo sa, že niektoré z nich môžu vyvolať naprogramovanú bunkovú smrť alebo „zastavenie“ bunkového cyklu, ako aj regulovať metabolizmus, bunkovú adhéziu, migráciu a proliferáciu, takže sú potenciálne prospešné pre liečbu nádorov.
 Kyselina 2,3-hydroxycinamová, fenol prítomný ako metabolit v ľudskom moči (zdroj: ED (EDGAR181) / Public Domain, Via Wikimedia Commons)
Kyselina 2,3-hydroxycinamová, fenol prítomný ako metabolit v ľudskom moči (zdroj: ED (EDGAR181) / Public Domain, Via Wikimedia Commons) Jedlo s fenolovými zlúčeninami
Pretože mnoho sekundárnych metabolitov produkovaných rastlinami má veľké množstvo fenolových zlúčenín, väčšina zeleniny, ktoré konzumujeme denne.
Rovnakým spôsobom majú všetky bunkové proteíny (zvieratá, zelenina a huby) rôzne proporcie tyrozínu, aminokyselinového proteínu s fenolovým kruhom.
 Free-image in www.Pixabay.com
Free-image in www.Pixabay.com Medzi hlavné bohaté potraviny fenoly a/alebo jeho deriváty vynikajú:
- olivy
- Hrozno
- Veľké množstvo ovocia a zeleniny
- ryža
- Aromatické korenie (oregano, korenie, koriander, kino, škorica, nechty vône, horčica, zázvor, aníz, kurkuma, mäta, atď.)
- bylinky
- Čaj a káva
- morská riasa
- orechy a iné orechy
- víno
- čokoláda
- Strukoviny a ďalšie semená
Odkazy
- Bento, C. & Gonçalves, Ana Carolina a Jesus, Fábio & Simões, Manuel & Silva, Luis. (2017). Fenolové zlúčeniny: zdroje, vlastnosti a aplikácie.
- Michałowicz, J., A pochybnosti, w. (2007). Fenolové zdroje a toxicita. Poľský denník environmentálnych štúdií, 16 (3).
- Minatel, i. Ani., Borges, c. Vložka., Ferreira, m. Jo., Gomez, h. Do. G., Chen, C. A. Ani., & Lima, G. P. P. (2017). Fenolické zlúčeniny: funkčné vlastnosti, vplyv spracovania a biologická dostupnosť. Fenolové zlúčeniny Biologická aktivita. Edimatizovať. Intech. Rijaka, Chorvátsko, 1-24.
- Santos-Buelga, C., Gonzalez-Manzano, s., Duceñas, m., & Gonzalez-Paramas, a. M. (2012). Extrakcia a izolácia fenolických kompundov. V izolácii prírodných produktov (PP. 427-464). Ľudská tlač.
- Séria, str. (2003). Chémia funkčnej skupiny. The Chemistry of Phenols, ed. Z. Rapoport.
- Tyman, J. H. (Devätnásť deväťdesiat šiestich). Syntetické a prírodné fenoly. Elsevier.
- Vuolo, m. M., Lima, v. Siež., & Junior, m. R. M. (2019). Fenolové zlúčeniny: štruktúra, klasifikácia a antioxidačná sila. V bioaktívnych zlúčeninách (str. 33-50). Vydavateľstvo.
- Wade, L. (2018). Encyclopaedia Britannica. Získané 6. mája 2020, z Britannica.com
- « Objavujú sa sociálne inštitúcie, charakteristiky, funkcie, príklady
- Štruktúra dusičnanu olovo, vlastnosti, získanie, použitia »

