Charakteristiky atómového modelu Thomsona, postuláty, subatomické častice
- 1203
- 355
- JUDr. Rudolf Čapkovič
On Thomson Atomic Model Bol vytvorený anglickým fyzickým oslavovaným j. J. Thomson, ktorý objavil elektrón. Kvôli tomuto objavu a jeho diela o elektrickom vedení plynov bola v roku 1906 udelená Nobelovou cenou vo fyzike.
Z jeho práce s katódovými lúčmi sa zistilo, že atóm nie je nedeliteľnou entitou, ako to Dalton predpokladal v predchádzajúcom modeli, ale že obsahoval dobre definovanú vnútornú štruktúru.

Thomson vyvinul atómový model založený na výsledkoch jeho experimentov s katódovými lúčmi. V ňom potvrdil, že atóm, elektricky neutrálny, bol vytvorený z pozitívnych a negatívnych nábojov s rovnakou veľkosťou.
[TOC]
Aký bol názov Thomsonovho atómového modelu a prečo?
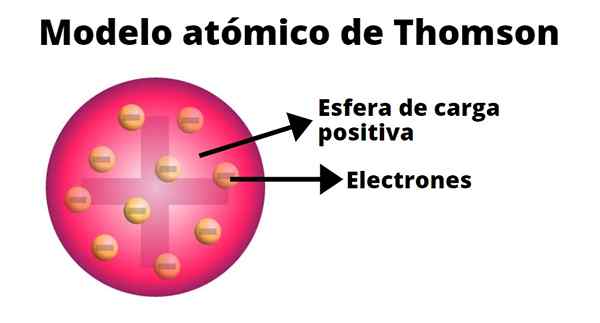
Podľa Thomsona bolo kladné zaťaženie distribuované v celom atóme a negatívne náboje boli vložené, akoby boli hrozienkami pudingu. Z tohto porovnania sa objavil pojem „puding Raisin“, pretože model bol neformálne známy.
 Joseph John Thomson
Joseph John Thomson Zatiaľ čo Thomsonova myšlienka je v súčasnosti dosť primitívna, pre jeho čas predstavoval nový príspevok. Počas krátkej platnosti modelu (v rokoch 1904 až 1910) mal podporu mnohých vedcov, hoci mnohí to považovali za kacírstvo.
Nakoniec v roku 1910 sa objavili nové dôkazy o atómovej štruktúre a Thomsonov model rýchlo zostal stranou. Stalo sa to hneď, ako Rutherford uverejnil výsledky jeho disperzných experimentov, ktoré ukázali existenciu atómového jadra.
Thomsonov model bol však prvý, kto predpokladal existenciu subatomických častíc a ich výsledky boli ovocím jemného a prísneho experimentovania. Týmto spôsobom stanovil precedens pre všetky nasledujúce objavy.
Charakteristiky a postuláty modelu Thomsona
Thomson prišiel k svojmu atómovému modelu na základe niekoľkých pozorovaní. Prvým bolo, že X -Rays, ktorý Roentgen novo objavil. Dovtedy jediný spôsob ionizácie bol chemicky oddelenie iónov na roztok.
Ale anglický fyzik úspešne ionizuje dokonca aj monooktomické plyny, ako je hélium, cez X -Rays. To ho viedlo k presvedčeniu, že zaťaženie vo vnútri atómu sa dá oddeliť, a preto to nebolo nedeliteľné.Tiež poznamenal, že katódové lúče sa dajú odkloniť elektrickými a magnetickými poľami.
 J.J. Thomson, objavca elektrónu. Zdroj: Lafer.
J.J. Thomson, objavca elektrónu. Zdroj: Lafer. Potom Thomson navrhol model, ktorý správne vysvetlil skutočnosť, že atóm je elektricky neutrálny a že katódové lúče sú zložené z častíc s negatívnym zaťažením.
Z prieskumu Experimentálne dôkazy, Thomson charakterizoval atóm takto:
-Atóm je elektricky neutrálna tuhá guľa s približným polomerom 10-10 m.
-Pozitívne zaťaženie je distribuované viac -menej rovnomerne guľou.
-Atóm obsahuje „mŕtvoly“ načítané negatívne, čo zaisťuje ich neutralitu.
-Tieto mŕtvoly sú rovnaké pre všetky veci.
-Keď je atóm v rovnováhe, existuje n mŕtvoly pravidelne usporiadané do krúžkov v kladnej gule zaťaženia.
-Hmotnosť atómu je rovnomerne rozložená.
Katódové lúče
 Elektrónový lúč sú nasmerované z katódy do anódy.
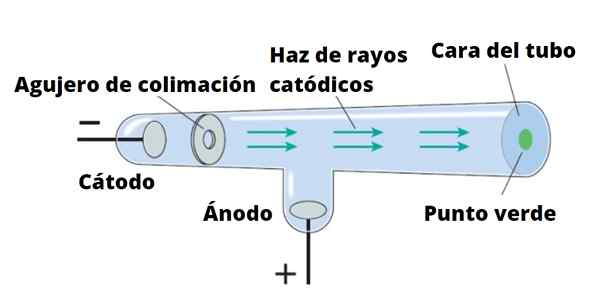
Elektrónový lúč sú nasmerované z katódy do anódy. Thomson uskutočnil svoje experimenty pomocou katódových lúčov, objavený v roku 1859. Katódové lúče sú negatívne nabité častice. Na ich produkciu sa používajú vákuové kryštálové trubice, v ktorých sa umiestnia dve elektródy, nazývané katóda a anóda.
Môže vám slúžiť: magnetizmus: magnetické vlastnosti materiálov, použitiePotom prechádza elektrický prúd, ktorý zahrieva katódu, ktorá tak emituje neviditeľné žiarenie, ktoré je nasmerované priamo do opačnej elektródy.
Na detekciu žiarenia, ktoré nie je nič iné ako katódové lúče, je stena trubice pokrytá fluorescenčným materiálom. Keď tam príde žiarenie, stena trubice vydáva intenzívnu svietivosť.
Ak je na ceste katódových lúčov vložený pevný objekt, hodí tieň na stenu trubice. To naznačuje, že lúče cestujú v priamke a tiež ich môžu ľahko zablokovať.
O povahe katódových lúčov sa široko diskutovalo, pretože jeho povaha bola neznáma. Niektorí si mysleli, že sú to elektromagnetické vlny, zatiaľ čo iní tvrdili, že sú to častice.
Subatomické častice Thomson Atomic Model
Thomsonov atómový model je, ako sme povedali, prvý, kto predpokladá existenciu subatomických častíc. Thomsonove korpusy nie sú nič iné ako elektróny, základné častice negatívne zaťaženého atómu.
V súčasnosti vieme, že ďalšie dve základné častice sú protónom, pozitívne načítané a neutrón bez zaťaženia.
Ale tieto sa neobjavili v tom čase, keď Thomson rozpracoval svoj model. Pozitívny náboj v atóme bol v ňom distribuovaný, nezohľadnil žiadne častice s uvedeným zaťažením a v súčasnosti neexistoval dôkaz o jeho existencii.
Z tohto dôvodu mal jeho model prchavú existenciu, pretože v priebehu niekoľkých rokov Rutherfordove experimenty s rozptylmi otvorili cestu pre objavenie protónov. A pokiaľ ide o neutron, Rutherford sám navrhol svoju existenciu niekoľko rokov predtým, ako bol konečne objavený.
Trubica Crookes
Sir William Crookes (1832-1919) navrhol trubicu, ktorá nesie jeho meno okolo roku 1870, s úmyslom starostlivo študovať povahu katódových lúčov. Pridal elektrické polia a magnetické polia a poznamenal, že lúče boli týmito odklonení.
 Schéma trubice katódy. Zdroj: Knight, r.
Schéma trubice katódy. Zdroj: Knight, r. Týmto spôsobom zistili Crookes a ďalší vedci vrátane Thomsona:
- Vo vnútri trubice lúčov katódy bol generovaný elektrický prúd
- Lúče boli odchýlené prítomnosťou magnetických polí rovnakým spôsobom, ako boli negatívne nabité častice.
- Každý kov použitý na výrobu katódy bol rovnako dobrý na výrobu katódových lúčov a ich správanie bolo nezávislé od materiálu.
Tieto pozorovania podporili diskusiu o pôvode katódových lúčov. Tí, ktorí tvrdili, že to boli vlny, boli založené na skutočnosti, že katódové lúče mohli cestovať v priamej línii. Okrem toho táto hypotéza veľmi dobre vysvetlila tieň, že vložený tuhý predmet hodil na stenu trubice a za určitých okolností sa známe, že vlny môžu spôsobiť fluorescenciu.
Ale namiesto toho nebolo pochopené, ako je možné, že magnetické polia odklonili katódové lúče. To malo iba vysvetlenie, ak sa tieto lúče považovali za častice, čo je hypotéza, ktorú Thomson zdieľal.
Častice naložené v rovnomerných elektrických a magnetických poliach
Častica naplnená zaťažením Q zažíva vieru v strede jednotného elektrického poľa a veľkosti:
Môže vám slúžiť: zvlnená teória svetla: vysvetlenie, aplikácie, príkladyViera = QE
Keď zaťažená častica kolmá na kríženie rovnomerného elektrického poľa, ako je napríklad, ktoré sa vyskytuje medzi dvoma doskami s opačným zaťažením, prežíva odchýlku, a preto zrýchlenie:
qe = ma
A = QE/M
Na druhej strane, ak sa zaťažená častica pohybuje s veľkosťou V rýchlosť, uprostred rovnomerného magnetického poľa s veľkosťou B, magnetická sila FM, ktorá prežíva, má nasledujúcu intenzitu:
Fm = qvb
Pokiaľ sú vektory rýchlosti a magnetického poľa kolmé. Keď zaťažená častica ovplyvňuje kolmo v homogénnom magnetickom poli, prežíva tiež odchýlku a jej pohyb je rovnomerný kruhový kruhový.
Centripetálne zrýchlenie nac V tomto prípade je to:
QVB = MAc
Zrýchlenie centripetálu zase súvisí s rýchlosťou častíc V a polomerom R kruhovej trajektórie:
doc = v2/R
Preto:
Qvb = mv2/R
Polomer kruhovej trajektórie sa dá vypočítať takto:
R = mv/qb
Neskôr sa tieto rovnice použijú na obnovenie spôsobu, akým Thomson odvodil pomer elektrónovej záťaže.
Thomsonov experiment
Thomson prešiel lúč katódových lúčov, elektrónový lúč, hoci stále nevedel, cez jednotné elektrické polia. Tieto polia sú vytvorené medzi dvoma vodivými doskami naloženými a oddelenými v malej vzdialenosti.
Catódové lúče tiež prešli rovnomerným magnetickým poľom a pozorovali účinok, ktorý to malo na lúč. V jednom poli aj na druhej strane došlo k vychýleniu v lúčoch, ktoré viedlo Thomsona k správnemu premýšľaniu, že lúč bol zložený z nabitých častíc.
Ak chcete skontrolovať, Thomson vykonal niekoľko stratégií s katódovými lúčmi:
- Meniť elektrické a magnetické polia, kým sa sily nezrušia. Týmto spôsobom prešli katódové lúče bez experimentovania deformácie. Zodpovedajúci elektrickým a magnetickým silám sa Thomsonovi podarilo určiť rýchlosť častíc lúča.
- Zrušil intenzitu elektrického poľa, týmto spôsobom sa častice nasledovali po kruhovej trajektórii uprostred magnetického poľa.
- Kombinovali výsledky krokov 1 a 2 na stanovenie pomeru zaťaženia „mŕtvoly“.
Pomer elektrónovej nákladu
Thomson zistil, že pomer nákladného mandátu častíc, ktorý predstavoval katódový lúč lúčov, má nasledujúcu hodnotu:
Q/M = 1.758820 x 10 11 c.kg-1.
Kde Q predstavuje zaťaženie „korpusclu“, čo je vlastne elektrón a m Je to hmotnosť toho istého. Thomson postupoval podľa postupu opísaného v predchádzajúcej časti, ktorú tu znovu obnovujeme, s rovnicami, ktoré použil.
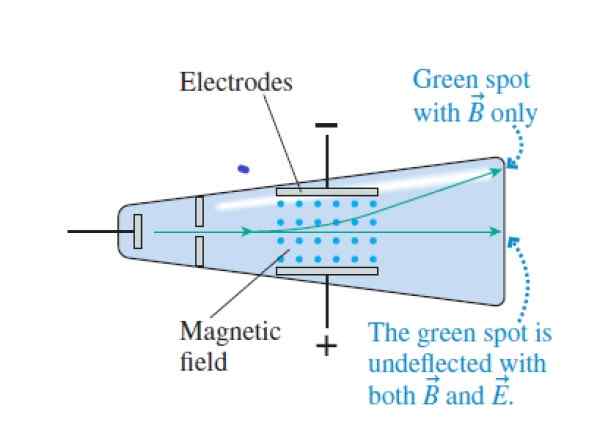 Keď katódové lúče prechádzajú cez kríž a magnetické polia, prechádzajú bez vychýlenia. Keď je elektrické pole zrušené, ovplyvňuje hornú časť trubice (magnetické pole je označené modrými bodmi medzi elektródami). Zdroj: Knight, r.
Keď katódové lúče prechádzajú cez kríž a magnetické polia, prechádzajú bez vychýlenia. Keď je elektrické pole zrušené, ovplyvňuje hornú časť trubice (magnetické pole je označené modrými bodmi medzi elektródami). Zdroj: Knight, r. Krok 1
Zodpovedajte elektrickou silou a magnetickou silou, prechádzaním lúčom cez kolmé elektrické a magnetické polia:
QVB = QE
Krok 2
Určite rýchlosť získanú časticami lúča, keď prechádzajú priamo bez vychýlenia:
V = e/b
Krok 3
Zrušte elektrické pole a zanechajte iba magnetické pole (teraz je tu vychýlenie):
R = mv/qb
S výsledkami v = e/b:
R = ja/qb2
Polomer obežnej dráhy je preto možné merať:
Q/m = v/rb
O dobre:
Q/m = e/rb2
Ďalšie kroky
Ďalšia vec, ktorú Thomson urobil, bolo zmerať kvocient q/m pomocou katód vyrobených z rôznych materiálov. Ako je uvedené vyššie, všetky kovy emitované katódové lúče s rovnakými charakteristikami.
Môže vám slúžiť: induktívna reaktanciaPotom Thomson porovnal svoje hodnoty s hodnotami q/m pomeru vodíka, získaného elektrolýzou a ktorého hodnota je približne 1 x 108 C/kg. Kvocient elektrónovej zaťaženia Masa je približne 1750-krát väčší ako vodíkový ión.
Preto katódové lúče mali oveľa väčšie zaťaženie alebo možno aj hmotnosť oveľa menšia ako vodíkový ión. Vodíkový ión je jednoducho protón, ktorého existencia bola známa čas po Rutherfordových disperzných experimentoch.
Dnes je známe, že protón je takmer 1800 -krát masívnejší ako elektrón as zaťažením rovnakej veľkosti a znakom je v rozpore s elektrónom.
Ďalším dôležitým detailom je to, že s Thomsonovými experimentmi nebolo stanovené elektrické nábojy elektrónu ani hodnota jeho hmotnosti osobitne. Tieto hodnoty boli stanovené prostredníctvom Millikanových experimentov, ktoré sa začali v roku 1906.
Rozdiely modelov Thomson a Dalton
Základný rozdiel týchto dvoch modelov je v tom, že Dalton si myslel, že atóm je guľa. Na rozdiel od Thomsona, nenavrhoval existenciu pozitívnych alebo negatívnych obvinení. Pre Daltona bol atóm taký:
 Atóm Dalton
Atóm Dalton Ako sme už videli, Thomson si myslel, že atóm je deliteľný a ktorého štruktúra je tvorená pozitívnou guľou a elektrónmi okolo.
Poruchy a obmedzenia modelu
V tom čase sa Thomsonovmu atómovému modelu podarilo veľmi dobre vysvetliť chemické správanie látok. Správne vysvetlil javy, ktoré sa vyskytli v trubici katódy Ray.
Ale v skutočnosti Thomson ani nenazval svoje častice „elektrónov“, hoci tento termín už predtým vytvoril George Johnstone Stoney. Thomson ich jednoducho nazval „corpuscles“.
Aj keď Thomson využil všetky vedomosti, ktoré mal momentálne, v jeho modeli existuje niekoľko dôležitých obmedzení, ktoré boli veľmi skoro zrejmé:
-Pozitívne zaťaženie nie je distribuované v celom atóme. Rutherfordove disperzné experimenty ukázali, že pozitívne zaťaženie atómu je nevyhnutne obmedzené na jeho malú oblasť, ktorá sa neskôr stala známym ako atómové jadro.
-Elektróny majú v každom atóme špecifické rozdelenie. Elektróny nie sú rovnomerne rozložené, napríklad hrozienka slávneho Buddínu, ale majú na orbitáloch dispozíciu, ktoré nasledujúce modely ukázali.
Presne je to dispozícia elektrónov v rámci atómu, ktorá umožňuje organizovanie prvkov pre ich charakteristiky a vlastnosti v periodickej tabuľke. Toto bolo dôležité obmedzenie modelu Thomsona, ktorý nedokázal vysvetliť, ako bolo možné týmto spôsobom objednať prvky.
-Atómové jadro je tie, ktoré obsahuje väčšinu cesta. Thomsonov model predpokladal, že hmotnosť atómu bola vo vnútri rovnomerne rozložená. Ale dnes vieme, že hmotnosť atómu je prakticky koncentrovaná v protónoch a neutronoch jadra.
Je tiež dôležité zdôrazniť, že tento model atómu neumožnil odvodiť typ pohybu, ktorý elektróny mali v rámci atómu.
Predmety záujmu
Schrödinger atómový model.
Broglie atómový model.
Atómový model Chadwick.
Heisenberg atómový model.
Perrin atómový model.
Atómový model Dalton.
Atómový model Dirac Jordan.
Atómový model demokritu.
Leucipo atómový model.
Bohr atómový model.
Sommerfeld atómový model.
Súčasný atómový model.
Odkazy
- Andriessen, m. 2001. HSC. Fyzika 2. Jacaranda HSC Science.
- Arfken, G. 1984. Fyzika univerzity. Akademická tlač.
- Rytier, r. 2017. Fyzika pre vedcov a inžinierstvo: Strategický prístup. Pearson.
- Rex, a. 2011. Základy fyziky. Pearson.
- Wikipedia. Thomson Atomic Model. Obnovené z: Je to.Wikipedia.orgán.
- « Všeobecné kvadratické rovnice, príklady, cvičenia
- Aomický model charakteristík Dirac Jordan a postulátov »

