Hydronio ión
- 965
- 66
- Valentín Dula
Čo je to hydrónsky ión?
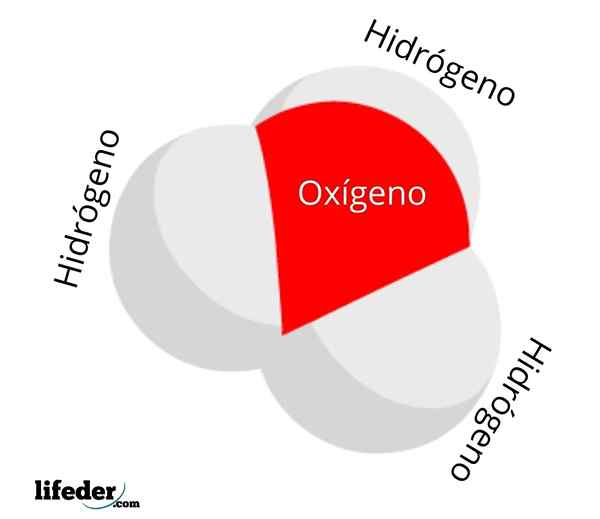
On Hydronio ión Je to druh pozitívneho zaťaženia, ktorý je výsledkom protonácie molekuly vody a ktorej chemický vzorec je H3Ani+. Skladá sa z najjednoduchších Oxoniánov: ióny, v ktorých kyslík má pozitívne formálne zaťaženie a má tri kovalentné väzby.
H3Ani+ Je to jeden z najjednoduchších, ale zvedavých katiónov, ktoré existujú. Vo vode za normálnych podmienok má koncentráciu 1,10-7 M, produkt rovnováhy seba samého. Jeho koncentrácia sa však zvyšuje exponenciálne, keď je silná3Ani+ Rozpúšťajú sa vo vode a okyslili ju.
 Molekula hydrónia
Molekula hydrónia Koncentrácia alebo aktivita H3Ani+ Vo vode slúži na meranie kyslosti vodných roztokov: pH. Čím viac H iónov3Ani+ Seno, menej pozitívne bude pH a je predmetným roztokom viac kyseliny. Táto kyslosť na druhej strane leží v vodíkovom ióne, h+, čo je často zamieňané s iónom H3Ani+.
 Iónový alebo hydronio katiónový vzorec
Iónový alebo hydronio katiónový vzorec H+ a jeho úžasná schopnosť prenosu medzi vodíkovými mostmi molekúl vody umožňuje H3Ani+ pridružiť sa v zložitejších katiónových formáciách; ako je vlastný katión, h9Ani4+, a Zundelov katión, h5Ani2+, a veľa ďalších.
Štruktúra hydrónia
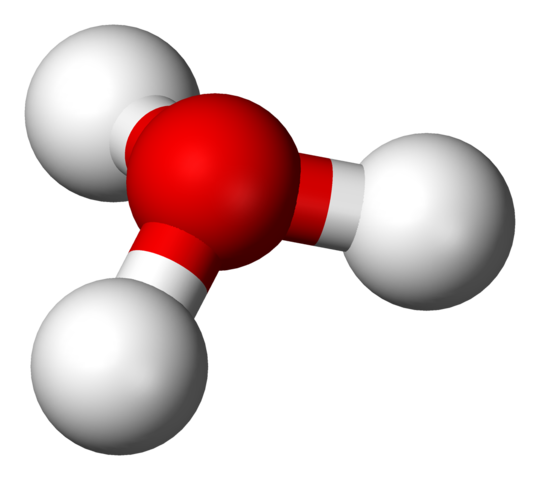 Štruktúra H3O+ s sférou a stĺpcovými modelmi
Štruktúra H3O+ s sférou a stĺpcovými modelmi Na prvom obrázku ste videli štrukturálny vzorec hydrium -iónu. Teraz vidíme jeho reprezentáciu s sférou a stĺpcovými modelmi. V obidvoch zdôrazňuje trigonálnu pyramídovú geometriu, ktorej uhly spojenia (O-H) sú 113 °; Trochu odklonený zo 119 ° pre Tetrahedron.
Aj keď kyslík má pozitívnu čiastočnú zaťaženie, neznamená to, že negatívna oblasť je okolo atómov vodíka. Naopak. Kyslík v h3Ani+ Je ešte viac elektronickým produktom jeho elektronického nedostatku; Takže všetka negatívna hustota vizualizovaná na mape elektrostatického potenciálu:
Môže vám slúžiť: síran draselný (K2SO4): Štruktúra, vlastnosti, použitie, syntéza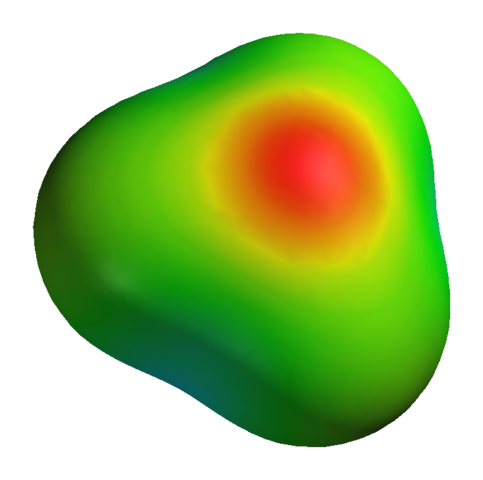 Mapa elektrostatického potenciálu pre H3o+
Mapa elektrostatického potenciálu pre H3o+ Nehovoriac o tom, že kyslík má niekoľko voľných elektrónov, čo posilňuje ešte viac negatívnej hustoty.
Dôsledkom všetkých vyššie uvedených je to, že H vodíny3Ani+ Stratia elektronickú hustotu, pretože kyslík ju priťahuje k sebe. Preto h3Ani+ Môžete vytvoriť veľmi silné zdroje vodíka so susednou molekulou vody: H2Ani+-H-oh2.
Táto interakcia je kľúčom za úžasnú iónovú mobilitu H+ A prečo h3Ani+ Je schopná spájať sa s mnohými molekulami vody súčasne.
Kyslosť
Hydronio ión je veľmi silná kyselina. V skutočnosti je to najsilnejšia kyselina, ktorá môže existovať vo vodnom roztoku. Pretože? Pretože akákoľvek iná kyselina silnejšia ako on bude protonovať molekulu vody, aby vznikla h3Ani+:
Ha + h2O → a- + H3Ani+
H3Ani+ Je schopný zostať stabilný vždy, keď v prostredí, ktoré sú silnejšie ako voda, nie sú žiadne iné základne. Akákoľvek kyselina, ktorú dodržiavala, bude klasifikovaná ako silná kyselina. Medzitým, ak je kyselina slabšia ako h3Ani+, Potom sa časť HA nebude úplne disociovať a budeme hovoriť o slabej kyseline:
Ha + h2Alebo ⇌ a- + H3Ani+
Preto od H3Ani+ Je to najsilnejšia kyselina, ktorá existuje vo vode, kyslosť bude závisieť od koncentrácie H3Ani+. Toto je základ na definovanie kyslosti vodného roztoku vyjadreného ako pH:
pH = -log [h3Ani+]
H+ vs. H3Ani+
Vodíkový ión a hydrón nie sú rovnaké. H+ Je oveľa kyslejší ako h3Ani+, Pozostáva z protónu nič viac, ktorý bude hľadať molekulu, aby získal elektróny vo všetkých prostriedkoch. Kedy h+ Získajte tvorbu molekuly vody h3Ani+:
Môže vám slúžiť: Cupric Oxid (CUO)H+ + H2O → h3Ani+
Preto h3Ani+ môže byť reprezentovaný ako h+(Ac), čo naznačuje, že je to h+ Vo vodnom médiu.
Sila kyseliny sa meria v jej schopnosti darovať podľa definície Brönsted-Lowry, H ióny+. O koľko je to silnejšie, tým viac bude darovať+, Žiadne h3Ani+. Najsilnejšie kyseliny, aké kedy syntetizovali (supercidy), sú tie, kde h+ Je „nahý“; to znamená, bez akejkoľvek prekážky skočiť smerom k molekule, ktorá bude protonovať.
Prax reprezentácie h3Ani+ ako h+(AC) Je také bežné, že sa mnohokrát hovorí o oboch, akoby boli rovnaké, bez toho, aby to negatívne ovplyvnilo interpretáciu chémie riešení.
Rozpustenie
H3Ani+ Môže tvoriť veľmi silné vodíkové mosty so susednou molekulou vody. Pritom máme katión Zundela, h5Ani2+:
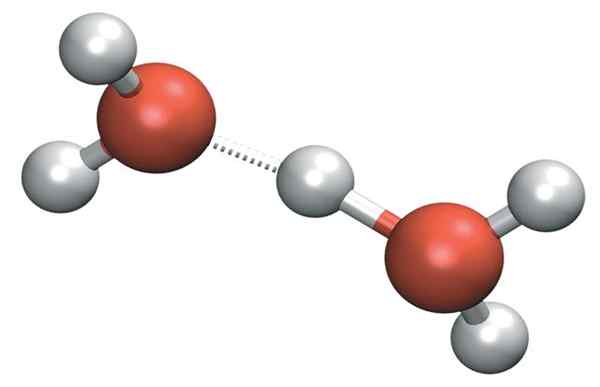 Katión
Katión Ale kladné zaťaženie zostáva nielen na jednej strane katiónu: toto sa môže preniesť do druhej molekuly vody, ako je ión h+:
H2O- h-+Oh2 → H2Ani+-H- oh2
Preto je kladná záťaž rozdelená medzi oba atómy kyslíka pre dve molekuly vody.
V prípade vlastného katiónu, h9Ani4+, h3Ani+ Vytvorte vodíkové mosty s tromi molekulami vody, ktoré medzi nimi rozdeľujú pozitívne zaťaženie vďaka „skoku“ h+. Tieto skoky sú také rýchle, že vysvetľujú veľkú iónovú mobilitu H+ Vo vode, pomocou h3Ani+ ako vozidlo a molekuly vody ako diaľnica.
H5Ani2+ a h9Ani4+ Nie sú to jediné katiónové združenia, ktoré h3Ani+ môže vzniknúť vo vode. Niektoré výpočty molekulárnej dynamiky demonštrujú existenciu klastra H3Ani+(H2Buď)dvadsať: 20 h molekuly2Alebo interakcia s katiónom3Ani+ a distribúcia medzi nimi kladné zaťaženie.
Môže vám slúžiť: Neodymium: Štruktúra, vlastnosti, použitiePreto h3Ani+ a h+ Budujú zvedavý vzťah s molekulami vody, nad rámec kyslosti.
Choď von
Rovnako ako existujú organické kyslíky. Jeho všeobecný vzorec je [h3Ani+] [X-], Kde x- Je to akýkoľvek anión, ktorý pochádza z rozpustenia veľmi silnej kyseliny.
Tieto soli niekedy dostávajú názov „monohydrátových kyselín“, pretože vzorec [h3Ani+] [X-] alebo h3Ani+· X- Môže byť tiež napísaný ako hx · h2Ani. Môžu teda existovať dihydrátové kyseliny, HX · 2H2Alebo, trihydráty, hx · 3H2Alebo, atď.
Napríklad HCl môže kryštalizovať ako HCl · h2O h3Ani+· Cl-. Máme tiež ďalšie hydrónske soli, ako napríklad h3Ani+· CLO4- alebo HCLO4· H2Alebo a HBR · 4h2O h3Ani+· Br-· 3H2Ani.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Inorgán chémiaICA. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Hydrónia. Zdroj: In.Wikipedia.orgán
- Avneet Kahlon a Stephen Lower. (15. augusta 2020). Hydrónsky ión. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- HelMestine, Anne Marie, PH.D. (25. augusta 2020). Definícia hydrónia. Zotavené z: Thoughtco.com
- Redaktori Enyclopaedia Britannica. (2020). Vodíkový ión. Získané z: Britannica.com

