Štruktúra hydroxidu draselného, vlastnosti, používa

- 1747
- 187
- Tomáš Mydlo
On hydroxid draselný Je to biela kryštalická anorganická pevná látka. Jeho chemický vzorec je koh. Jeho kryštály ľahko absorbujú vzduch zo vzduchu, takže sa hovorí, že ide o hygroskopickú zlúčeninu. Je to silná báza a absorbuje oxid uhličitý (CO2) životného prostredia.
Priemyselne sa vyskytuje elektrolýzou chloridu draselného (KCL). Z dôvodov ochrany energie a čistoty produktu sa pri tejto metóde používajú ortuťové bunky (HG).
 Pearly hydroxidu draselného (KOH). Nie je k dispozícii žiadny strojovo čitateľný autor. Walkerma predpokladala (na základe nárokov na autorské práva). [Verejná doména] Zdroj: Wikipedia Commons
Pearly hydroxidu draselného (KOH). Nie je k dispozícii žiadny strojovo čitateľný autor. Walkerma predpokladala (na základe nárokov na autorské práva). [Verejná doména] Zdroj: Wikipedia Commons Ale už mnoho rokov sa obávali kontaminácia ortuti, ktorá generuje tento proces. V skutočnosti sú výboje na odpady odpadu obsahujúce ortuť prísne zakázané. Existujú aj ďalšie procesy, ako je bránica a membrána.
Existujú tiež neelektrochemické procesy, ako je rozklad dusitanu draselného (Kno2) V prítomnosti oxidu železitého (viera2Ani3).
Roztoky KOH získané v priemyselných procesoch sa odparujú, aby sa dosiahol KOH na 90-95%. Zvyškový obsah vody 5-10% je spojený s KOH vo forme monohydrátu hydroxidu draselného (KOH (KOH.H2Buď).
Vďaka svojim žieravým vlastnostiam a silnej základnosti má veľmi rozmanité aplikácie. Slúži ako surovina v mydlách a detergentoch, tlači alebo kozmetických farbách, okrem iného. Používa sa tiež na umývanie priemyselných plynov, pri detekcii húb mikroskopom a má aplikáciu v potravinárskom priemysle.
Aj keď je to veľmi stabilná zlúčenina, je klasifikovaný ako korozívny. Musí sa s ňou manipulovať opatrne, pretože môže spôsobiť popáleniny v očiach, koži a slizniciach.
[TOC]
Štruktúra
Kryštál KOH pri bežných teplotách je monoklinický, pričom každý atóm draslíka (K) je obklopený oktaedro skreslenými z atómov kyslíka (O). Hydroxylové (OH) skupiny na druhej strane tvoria reťazec v tvare kľukatého v tvare vodíkov, kde sú vzdialenosti O-O 3,35 A, pričom zlikviduje akúkoľvek významnú vodíkovú väzbu.
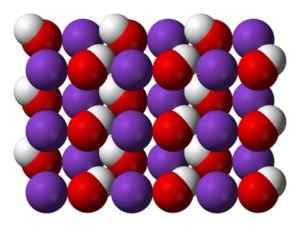 Kryštalická štruktúra KOH pri bežných teplotách. Modrá: draslík, červená: kyslík, biela: vodík. Benjah-Bmm27 [verejná doména]. Zdroj: Wikipedia Commons
Kryštalická štruktúra KOH pri bežných teplotách. Modrá: draslík, červená: kyslík, biela: vodík. Benjah-Bmm27 [verejná doména]. Zdroj: Wikipedia Commons Pri vysokých teplotách má KOH kubický kryštalický tvar.
Môže vám slúžiť: Plavba pre tégliku: Charakteristiky, funkcie, použite príkladyMenovanie
- Hydroxid draselný.
- Žieravec.
- Hydrát draslíka.
- Draslík.
Vlastnosti
Fyzický stav
Biela kryštalická pevná látka.
Molekulová hmotnosť
56 106 g/mol.
Bod topenia
380 ° C; Bolo tiež hlásené 406 ° C (líši sa podľa obsahu vody). Technický titul (90-92% KOH) sa topí približne 250 ° C.
Bod varu
1327 ° C.
Hustota
2 044 g/cm3
Rozpustnosť
Rozpustný v studenej vode (107 g/100 ml pri 15 ° C) a horúcej vody (178 g/100 ml pri 100 ° C). Jeho rozpustenie vo vode je veľmi exotermický proces, čo znamená, že sa vytvára veľké množstvo tepla.
Rozpustný v alkoholu. Rozpustný v glyceríne. Nerozpustný v éteri.
pH
13,5 (v 0,1 molárnej vodnej roztoku).
Ďalšie vlastnosti
Jeho kryštály sú delikátne alebo hygroskopické, čo znamená, že absorbuje vzduch zo vzduchu. Tiež ľahko absorbuje CO2 zo vzduchu.
Jeho chemické reakcie sú charakteristiky silnej bázy. Vo vodnom roztoku reaguje s akoukoľvek slabou kyselinou, aby vytvorila draslíkovú soľ kyseliny. Napríklad reaguje s kyselinou uhličitou (H2Co3) alebo s oxidom uhličitým (CO2) Na vytvorenie uhličitanu hydrogenuhličitanu alebo uhličitanu draselného.
Reaguje s alkoholmi za vzniku alcoxidov draselného alebo s obsahom sulfidu vodíka H2S Za vznik sulfidu alebo bisulfidu draselného.
Vo vodných systémoch tvorí KOH niekoľko hydrátov: mono-, di- a tetra-hydráty.
Koh vodné roztoky sú bezfarebné, silne základné, mydlové a žieravé. Je to korozívny materiál, tuhý aj v roztoku.
Nie je to horľavé, ale keď sa zahrieva, až kým jeho rozklad emituje toxické a korozívne fajčenie K2Ani.
Spôsobuje silné popáleniny v očiach, koži a slizniciach a v kontakte s kovmi, ako je hliník, cín, olovo alebo zinok, môže generovať vývoj plynného vodíka (h (h2), čo je vysoko horľavé.
Teplo vyrobené, keď príde do kontaktu s vlhkosťou alebo inými látkami, môže spôsobiť dostatok tepla na zapnutie horľavých materiálov.
Žiadosti
Pri výrobe iných zlúčenín draslíka
Hydroxid draselný sa používa ako surovina pre chemický a farmaceutický priemysel. Slúži na výrobu uhličitanu draselného (k2Co3), Draslík permanganát (kmno4), fosforečnan draselný (k3Po4), kremičitan draselný (k2SIO3) a kyanid draselný (KCN), okrem iných zlúčenín.
Môže vám slúžiť: lineárne alkány: Štruktúra, vlastnosti, nomenklatúra, príkladyV niekoľkých aplikáciách
KOH s vysokou čistotou má aplikáciu pri výrobe pesticídov, syntéze atramentu a farbív, chemikálií pre gumovú alebo galvanoplastiku, litografiu atď.
Technický titul KOH sa používa ako surovina v priemysle detergentov a mydiel; Pri výrobe kozmetiky, skla a textilu; Duesenie ropy; ako sušiaci agent a pri odstraňovaní obrazov a lakov, okrem iného.
Je tiež užitočné ako žieravé činidlo v drevenom priemysle, v mercerizácii bavlny, v analytickej chémii pre alkalimetrické tituly, organické a vodné úpravy.
V lekárskych aplikáciách
V medicíne sa používa pri mokrej zostave počas prípravy klinických vzoriek na mikroskopickú vizualizáciu húb a iných plesňových prvkov v koži, vlasoch, nechtoch,.
Príprava KOH sa používa na objasnenie klinického materiálu, aby bolo možné ľahšie vidieť plesňové prvky.
Fragment klinickej vzorky sa pridá do 10% roztoku KOH na sklenenom posúvaní. Potom prikryte krycím objektom a nechajte stáť pri teplote miestnosti, aby sa umožnilo trávenie hostiteľských buniek. Nakoniec sa pozoruje s mikroskopom.
 Mikroskop. Obraz Kontantin Kolosov. Zdroj: Pixabay
Mikroskop. Obraz Kontantin Kolosov. Zdroj: Pixabay Na druhej strane je KOH vo forme lokálneho roztoku účinný pri liečbe bradavíc.
V kozmetickom priemysle
Používa sa v niektorých výrobkoch na čistenie nechtov, krémov na holenie a mydlá, pretože jeho korozívna vlastnosť je veľmi efektívna pri rozkladu alebo odstraňovaní mäkkého tkaniva a odstraňovania vlasov.
 Mydlá. Rituálny obraz. Zdroj: Pixabay
Mydlá. Rituálny obraz. Zdroj: Pixabay V poľnohospodárstve
Používa sa v hnojivách a iných poľnohospodárskych výrobkoch, ako sú herbicídy a pesticídy.
V priemyselných chemických procesoch
KOH je užitočný pri čistení a čistení priemyselných plynov, najmä ak je potrebné odstrániť kyseliny.
Môže vám slúžiť: Henderson-Haselbalchova rovnica: Vysvetlenie, príklady, cvičenieNapríklad pre svoju ľahkosť reagovať s CO2, Používa sa na absorbovanie tohto plynu. Okrem toho je ideálne reagovať s kyselinami, takže slúži na odstránenie kyseliny sulfhydrovej (H2S). A podobne na odstránenie oxidov dusíka.
 Priemyselný proces. Obrázok Michael Gaida. Zdroj: Pixabay
Priemyselný proces. Obrázok Michael Gaida. Zdroj: Pixabay V potravinárskom priemysle
Používa sa na úpravu pH, ako stabilizátor a ako zahusťovací agent v potravinárskom priemysle.
Zohľadnil ju Úrad pre potraviny a liečivá v USA alebo FDA (za svoju skratku pre angličtinu Úrad pre potraviny a liečivá), Ako priama zložka u ľudí, za predpokladu, že sa používa za podmienok týkajúcich sa dobrých výrobných postupov.
Pri získavaní bionafty
Bionafta je nafta alebo nafta na subseel z horľavej kvapaliny. Získava sa z rastlinných olejov alebo živočíšnych tukov. KOH sa používa ako katalyzátor pri výrobe bionafty.
Nedávne štúdie
Niekoľko rokov sa pozornosť venuje kontaminácii moria v dôsledku plastového odpadu, ktorý postihuje viac ako 550 druhov morskej fauny, a to tak pre požitie plastom, ako aj na uväznenie medzi odpadom.
Z tohto dôvodu sa snažíme nájsť metódy, ktoré umožňujú spracovanie vzoriek tráviacich traktov zvierat, ktoré rozpúšťajú organický materiál, ale bez rozpustenia plastov požívaných vzorkami.
V tomto zmysle sa zistilo, že použitie riešení KOH na oddelenie plastov od organických látok je praktická a účinná metóda, ktorá môže byť veľmi užitočná pri kvantitatívnych štúdiách plastického požitia z divočiny voľne žijúcich živočíchov.
Odkazy
- Mahmoud a. Ghanoum a Nancy C. Isham. (2009). Dermatofyty a dermatofytóza. V klinickej mykológii. Druhé vydanie. Zotavené z vedeckých pracovníkov.com.
- Kühn, s. a kol. (2016). Využitie roztoku hydroxidu draselného (KOH) ako vhodný prístup na izoláciu plastov požitých morskými organizmami. V bulletine o morskom znečistení. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 19. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A22. VCH Verlagsgellschaft MBH.
- Lekárska knižnica. (2019). Hydroxyd draslíka. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Krisada Nooioj a kol. (2009). V porovnávacej štúdii KOH/AL2Ani3 a katalyzátory KOH/Nay na výrobu bionafty prostredníctvom transciterifikácie z palmového oleja. V obnoviteľnej energii. Zotavené z vedeckých pracovníkov.com.
- « Charakteristiky organizačných hodnôt, dôležitosť, príklady
- Územie Alsacia a Lorena, pozadie, svetové vojny »

