Štruktúra hydridu hliníka (ALH3), vlastnosti, použitie
- 3615
- 965
- Gabriel Bahna
On Hliníkový hydrid Je to anorganická zlúčenina, ktorej chemický vzorec je alh3. Aj keď sa zdá byť jednoduchý charakter, je to vlastne trochu zložitá látka. Kvôli kryštalickému jasu, ktorý sa môže vyskytnúť v jeho pevnej látke, sa zvyčajne berie ako iónový hydrid, tvorený iónmi do3+ a h-.
Jeho vlastnosti však ukazujú inak: je to polymérna pevná látka, ktorej najvernejšie zastúpenie by bolo typu (alh3)n, bytosť n Počet monomérnych jednotiek Alh3 To by integrovalo sklenenú reťaz alebo vrstvu. Preto alh3 Je to jeden z tých polymérov, ktorý dokáže prijať kryštalickú štruktúru.
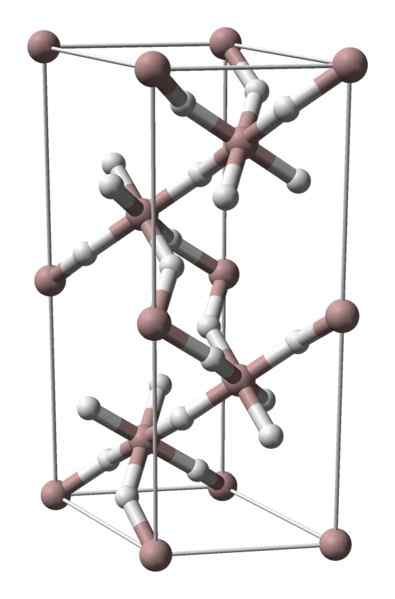 Kryštalická štruktúra hydridu hliníka. Zdroj: Benjah-Bmm27 / verejná doména
Kryštalická štruktúra hydridu hliníka. Zdroj: Benjah-Bmm27 / verejná doména Hliníkový hydrid nie je tuhý s množstvom komerčnej difúzie, takže jeho dostupné obrázky sú vzácne. Používa sa najmä na organickú syntézu, kde slúži ako silné redukčné činidlo. Zaberá tiež osobitné miesto v technologickom pokroku materiálov, čo je sľubnou alternatívou pre skladovanie vodíka.
Táto zlúčenina, tiež nazývaná Alano, udržiava úzky vzťah s liaalhom4, ktorých mená sú hydrid hliníka a lítium, lítium alanate alebo lítium tetrahydroaluminácia. Aj keď má polymérne charakteristiky a tepelnú metastabilitu, vyskytuje sa v siedmich polymorfoch s rôznymi kryštalickými morfológiami.
[TOC]
Štruktúra
Koordinácia
 Oktaedrálna koordinácia hliníkových katiónov v kryštáli ALH3. Zdroj: Benjah-Bmm27 / verejná doména.
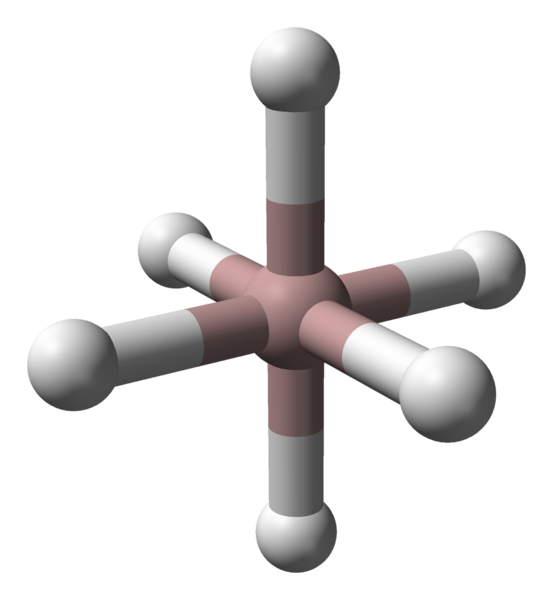
Oktaedrálna koordinácia hliníkových katiónov v kryštáli ALH3. Zdroj: Benjah-Bmm27 / verejná doména. Bez ohľadu na to, že sa uvažuje o polymorfu alebo kryštalickej fáze, koordinácia medzi atómami hliníka a vodíka je konštantná. Napríklad na hornom obrázku, rovnako ako na prvom obrázku, je na prvom obrázku zobrazený koordinačný oktadron pre atómy hliníka (hnedá guľa).
Môže vám slúžiť: Stoichiometrické zákonyKaždý atóm je obklopený šiestimi h, čím sa zakladá šesť spojení Al-H. Spôsob, akým je oktaedra orientovaný vo vesmíre, spôsobí štrukturálny rozdiel medzi jedným polymorfom a druhým.
Na druhej strane je každý atóm H koordinovaný s dvoma atómami Al, ktorý vytvára väzbu Al-H-Al, ktorá by mohla byť odôvodnená spojením typu 3C2E (elektróny 3 Centers-2). Tento odkaz je zodpovedný za vstup do niekoľkých oktaedros alh6 v celom Alano Crystal.
Izolovaná molekula
Alh3 Sa považuje za polymérne z dôvodu sietí ALH6 ktoré integrujú sklo. Na izoláciu jednotlivej molekuly Alano je potrebné aplikovať nízke tlaky v inertnej atmosfére šľachtického plynu. Týmto spôsobom sa polymér zlomí a uvoľňuje molekuly Alh3 z trigonálnej plochej geometrie (analogická s BH3).
Na druhej strane je možné znížiť dva alh3 vytvoriť a2H6, Rovnako ako v prípade Diborano, b2H6. Na dosiahnutie tohto cieľa sa však vyžaduje použitie tuhého vodíka, takže nemusí mať veľa priemyselnej alebo komerčnej dlhej hodnoty.
Polymorfy
Alano alebo Alh3 Je schopný tvoriť až sedem polymorfov: a, a ', β, y, ε a ζ, z ktorých a je najstabilnejšie zmeny teploty. A-alh3 Rozlišuje sa tým, že má kubickú morfológiu a šesťuholníkovú kryštalickú štruktúru. To má tendenciu byť produktom, v ktorom sa ostatné polymorfy transformujú, keď trpia tepelnou destabilizáciou.
Morfológia y-alh3, Na druhej strane, vyniká to, že je typu ihly. Preto Alh3 tuhá látka môže obsahovať zmes viac ako dvoch polymorfov a prítomnosť rozmanitých kryštálov mikroskopu.
Vlastnosti
Fyzický vzhľad
Hliníkový hydrid je bezfarebný alebo belavý tuhý, kryštalický vzhľad s tendenciou vykazovať tvary ihly.
Môže vám slúžiť: kyselina sulfónová: štruktúra, nomenklatúra, vlastnosti, použitiaMolárna hmota
29.99 g/mol o 30 g/mol
Bod topenia
150 ° C. Ale začína sa zlomiť z 105 ° C.
Rozpustnosť
Vysoko reagujte s ňou.
Rozpustnosť
Nerozpustný v dietyléter a apolárnych rozpúšťadlách, ako je benzén a pentán. Reaguje s alkoholmi a inými polárnymi rozpúšťadlami.
Rozklad
Alh3 Je náchylný na rozklad rôznym rýchlostiam v závislosti od vonkajších podmienok, morfológie a tepelnej stability ich kryštálov alebo použitia katalyzátorov. Ak sa tak stane, uvoľňuje vodík a transformuje sa na kovový hliník:
2ALH3 → 2AL + 3H2
V skutočnosti tento rozklad skôr ako problém predstavuje jeden z dôvodov, prečo sa Alano považuje za zaujímavý pri vývoji nových energetických technológií.
Formácia aduktu
Keď Alh3 Nereaguje s rozpúšťadlom nezvratne, vytvára s ním adukt, to znamená typ komplexu. Napríklad môžete vytvoriť komplex s trimetylamínom, Alh3· 2n (Cho3)3, S tetrahydrofurano, alh3· Thf alebo s dietetiletrom, alh3Et2Ani. Ten bol najznámejší, keď bola syntéza alebo získanie Alana zavedená v roku 1947.
Získanie
Prvé vystúpenia Alh3 Dávajú sa do roku 1942 a 1947, čo je minulý rok, keď bola jeho syntéza predložená pomocou Lialh4 V dietylovom médiu:
3LIALH4 + Alcl3+ nEt2O → 4ALH3 · nEt2O + 3LICL
Éterické roztok, Alh3 · nEt2Alebo sa musel podrobiť sklamaniu, s účelom odstránenia ET2Alebo a získajte alh3 čistý. Okrem tohto problému by sa mal LICL vylúčiť zo média výrobkov.
Od roku 1950 do roku 1977 bola teda navrhnutá nová syntéza na získanie lepších výnosov ALH3, ako aj najčistejšie tuhé látky a lepšie tepelné a morfologické vlastnosti. Modifikácia použitých množstiev, krokov a nástrojov je možné uprednostňovať získanie polymorfu nad ostatnými. Avšak a-alh3 Zvyčajne je to väčšinový produkt.
Môže vám slúžiť: Alilo: alyická jednotka, karbocation, radikálne, príkladyĎalšie metódy syntézy pozostávajú z využívania elektrochémie. Na tento účel sa používa hliníková anóda a platinová katóda. V anóde prechádza nasledujúca reakcia:
3ALH4- + Do3+ + nTHF → 4ALH3 · nThf + 3e-
Zatiaľ čo v katóde sa získava kovový sodík. Potom Alh3 · nTHF tiež podstúpi rozčarovanie, aby odstránil THF a nakoniec získal alh3.
Žiadosti
Redukčné činidlo
Alh3 Slúži na zníženie určitých funkčných skupín organických zlúčenín, ako sú karboxylové kyseliny, ketóny, aldehydy a estery. Prakticky to, čo robí, je pridať vodíny. Napríklad ster sa môže zredukovať na alkohol v prítomnosti skupiny nitro:
 Redukcia ster s hydridom z hliníka. Zdroj: zázvor / verejná doména.
Redukcia ster s hydridom z hliníka. Zdroj: zázvor / verejná doména. Vodík
Hliníkový hydrid predstavuje alternatívu, ktorá slúži ako vodíkový nádrž, a preto ho dokáže nahradiť v zariadeniach, ktoré pracujú s vodíkovými batériami. Zväzky získané z H2 zodpovedajú väčšiemu objemu dvojitého ako alh3.
Mať Alh3, a jeho kontrolované, je možné uvoľniť určité požadované množstvo H2 kedykoľvek. Preto by sa mohla použiť ako raketové palivo a všetky tie energetické aplikácie, ktoré sa snažia využiť spaľovanie vodíka.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Hydridový hliník. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Hydridový hliník. Databáza pubchem., CID = 14488. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- J. Graetz a kol. (2011). Hliníkový hydrid ako materiál na skladovanie vodíka a energie: minulosť, súčasnosť a budúcnosť. Elsevier B.Vložka.
- Xu Bo a kol. (2014). Príprava a tepelné vlastnosti polymorfov hydridu študentov. doi.org/10.1016/j.Vákuum.2013.05.009
- « Koncept lineárnej variácie, príklady, cvičenie vyriešené
- Forma Zeme a jej fyzické a astronomické následky »

