Štruktúra, vlastnosti a použitia Heptano (C7H16)
- 4351
- 157
- Gabriel Bahna
On heptano Je to organická zlúčenina, ktorej chemický vzorec je C7H16 a obsahuje deväť štrukturálnych izomérov, z ktorých najznámejší je lineárny. Je to uhľovodík, konkrétne alkán alebo parafín, ktorý je vo väčšine organických laboratórií chémie, či už výučby alebo výskum.
Na rozdiel od iných parafínových rozpúšťadiel má Heptano nižšiu volatilitu, čo robí relatívne bezpečnejšie; Kedykoľvek nie je žiadny zdroj tepla, ktorý by obklopoval vaše výpary, a pracuje sa vo vnútri extraktorového zvončeka. Ponechanie jeho horľavosti stranou je dostatočne inertná zlúčenina, ktorá slúži ako prostriedok organických reakcií.
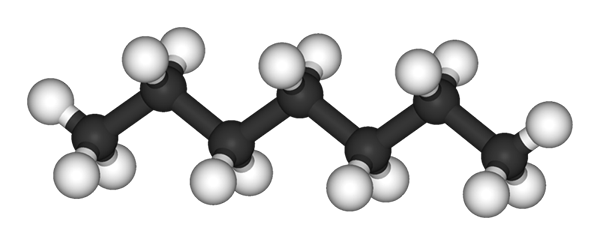
 Molekula N-heptano predstavovaná modelom guľôčok a stĺpcov. Zdroj: Ben Mills a Jynto [verejná doména]
Molekula N-heptano predstavovaná modelom guľôčok a stĺpcov. Zdroj: Ben Mills a Jynto [verejná doména] Na hornom obrázku máte štruktúru n-Heptano, lineárny izomér všetkých heptanov. Pretože je to najbežnejší izomér a väčšia komerčná hodnota, ako aj najjednoduchší syntéza, má tendenciu byť na konci, že pojem „heptano“ sa vzťahuje výlučne n-Heptano; pokiaľ nie je uvedené inak.
Avšak vo fľašiach tejto kvapalnej zlúčeniny je špecifikované, že obsahuje n-heptano. Musia sa odhaliť vo vnútri zvončeka extraktora a starostlivo vykonávať merania.
Je to vynikajúce rozpúšťadlo pre tuky a oleje, takže sa často používa počas rastlinných esencií alebo iných prírodných produktov.
[TOC]
Štruktúra
N-heptán a jeho intermolekulárne interakcie
Ako je vidieť na prvom obrázku, molekula n-Heptano je lineárny a kvôli chemickej hybridizácii jeho atómov uhlíka si reťazec prijíma tvar zigzagueady. Táto molekula je dynamická, pretože jej väzby C-C sa môžu otáčať, vďaka čomu sa reťaz mierne zloží v rôznych uhloch. To prispieva k jeho intermolekulárnym interakciám.
Môže vám slúžiť: PI odkazOn n-Heptano je apolárna hydrofóbna molekula, a preto jej interakcie sú založené na disperzných silách v Londýne; To sú tie, ktoré závisia od molekulárnej hmotnosti zlúčeniny a jej kontaktnej plochy. Dve molekuly n-heptan.
Tieto interakcie sú dostatočne účinné na udržanie molekúl n-Heptano súdržná v tekutine, ktorá vrie na 98 ° C.
Izoméry
 Deväť izomérov Heptan. Zdroj: Steffen 962 [verejná doména]
Deväť izomérov Heptan. Zdroj: Steffen 962 [verejná doména] Spočiatku sa hovorilo, že vzorec C7H16 predstavuje celkom deväť štrukturálnych izomérov, čo je n-heptán najrelevantnejší (1). Ďalších osem izomérov je znázornených na hornom obrázku. Všimnite si voľným okom, že niektoré sú viac rozvetvené ako iné. Zľava doprava, počnúc zhora, máme:
(2): 2-metylhexan
(3): 3-metylhexan, ktorý pozostáva z dvojice enantiomérov (A a B)
(4): 2,2-dimetylpentano, známe tiež ako Neoheptano
(5): 2,3-dimetylpentano, opäť s párom enantiomérov
(6): 2,4-dimetylpentano
(7): 3,3-dimetylpentano
(8): 3-etylpentán
(9): 2,2,3-trimetylbután.
Každý z týchto izomérov má nezávislé vlastnosti a aplikácie n-Heptano, vyhradené viac ako čokoľvek pre oblasti organickej syntézy.
Vlastnosti hepthane
Fyzický vzhľad
Bezfarebná tekutina s vôňou podobnou benzínu.
Molárna hmota
100 205 g/mol
Bod topenia
-90 549 ° C, ktorý sa stáva molekulárnym kryštálom.
Bod varu
98,38 ° C.
Tlak vodnej pary
52,60 atm pri 20 ° C. Všimnite si, aký vysoký je váš tlak pary, napriek tomu, že je menej prchavý ako iné parafínske rozpúšťadlá, ako sú Hexano a Pentan.
Hustota
0,6795 g/cm3. Na druhej strane, heptano pary sú 3,45 -krát husté ako vzduch, čo znamená, že ich výpary vydržia v priestoroch, kde sa trochu rozliate ich tekutiny.
Môže vám slúžiť: kyselina mravčová (HCOOH)Rozpustnosť
Heptán za to, že je hydrofóbnou zlúčeninou, sa môže sotva rozpustiť vo vode, aby spôsobil roztok s koncentráciou 0,0003% pri teplote 20 ° C.
Rozpustnosť v iných rozpúšťadlách
Hepthane je miešateľný s uhlíkom tetrachloridom, etanolom, acetónom, ropným éterom a chloroformom.
Index lomu (nD)
1 3855.
Hrebeň
0,389 MPa · s
Tepelná kapacita
224,64 j/k · mol
zapaľovač
-4 ° C
Teplota
223 ° C
Povrchové napätie
19,66 Mn/m A 25 ° C
Spaľovacie teplo
4817 kj/mol.
Reaktivita
Vary hepthane, keď sú blízko k zdroju tepla (plameň), reagujte exotermitne a dôrazne s kyslíkom vzduchu:
C7H16 + 11o2 => 7Co2 + 8h2Ani
Avšak mimo spaľovacej reakcie je heptán pomerne stabilná tekutina. Jeho nedostatočná reaktivita je spôsobená skutočnosťou, že ich C-H prepojenia je ťažké prelomiť, takže nie je náchylné na substitúcie. Nie je tiež príliš citlivý na silné oxidačné činidlá za predpokladu, že v okolí nie je požiar.
Najväčšie nebezpečenstvo Heptana predstavuje jeho vysoká volatilita a horľavosť, takže existuje riziko požiaru, ak sa vyliaje do horúcich miest.
Žiadosti
Rozpúšťadlo a polovica reakcie
 Hepthane je vynikajúce rozpúšťadlo na rozpustenie oleja a tukov. Zdroj: pxhere.
Hepthane je vynikajúce rozpúšťadlo na rozpustenie oleja a tukov. Zdroj: pxhere. Hydrofóbny charakter heptano je vynikajúcim rozpúšťadlom na rozpustenie olejov a tukov. V tomto aspekte sa používa ako odmastiteľ. Jeho najväčšia aplikácia však spočíva v tom, že sa používa ako rozpúšťadlo extraktora, pretože rozpúšťa lipidové komponenty, ako aj ďalšie organické zlúčeniny vzorky.
Napríklad, ak by ste chceli extrahovať všetky komponenty mletej kávy, namiesto vody by to bolo macerované v heptáne namiesto vody. Táto metóda a jej variácie boli implementované so všetkými typmi semien, vďaka ktorým boli získané rastlinné esencie a iné prírodné produkty.
Môže vám slúžiť: Unitárna bunka: Vlastnosti, červené konštanty a typyHeptán, ktorý je prirodzene bezfarebný, bude zafarbená z farby extrahovaného oleja. Potom sa otočí, aby sa konečne mal objem oleja čo najčistejší.
Na druhej strane, malá reaktivita heptánu vám tiež umožňuje byť možnosťou pri zvažovaní reakčných prostriedkov na vykonanie syntézy. Keďže je dobrým rozpúšťadlom organických zlúčenín, zaručuje, že činidlá zostávajú v roztoku a vzájomne interagujú, keď reagujú.
Precipitačný prostriedok
V ropnej chémii je bežnou praxou zrážať asfaltény surovej vzorky pridaním Heptano. Táto metóda umožňuje študovať stabilitu rôznych surovín a určovanie toho, ako je citlivý jeho obsah asfalténov, precipitovať a prenášať celú sériu problémov pre ropný priemysel.
Oktán
Heptan sa používa ako palivo v dôsledku veľkého množstva tepla, ktoré ponúka, keď horí. Pokiaľ však. Pretože horí veľmi výbušne, slúži na definovanie 0 v oktánovej stupnici benzínu.
Benzín obsahuje vysoké percento heptano a iných uhľovodíkov na rovnosť oktánu na známe hodnoty (91, 95, 87, 89 atď.).
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Heptán. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Databáza heptánu pubchem. CID = 8900. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Elsevier B.Vložka. (2020). Heptani. Vedecký. Zdroj: ScienceDirect.com
- Zbor Bell Chem. (7. september 2018). Priemyselné použitie heptánu. Získané z: Bellchem.com
- Andrea Kropp. (2020). Heptán: Štruktúra, použitie a receptúra. Štúdium. Získané z: štúdie.com
- « Kondenzovaný vzorec Čo je a príklady (metán, etán, glukóza ...)
- Mechanické vzorce energie, koncept, typy, príklady, cvičenia »

