Štruktúra hliníka fosfuro (AIP), vlastnosti, použitie, riziká

- 1508
- 228
- MUDr. Miloslav Habšuda
On hliníkovo fosfid Je to anorganická zlúčenina tvorená atómom hliníka (AL) a atómom fosforu (P). Jeho chemický vzorec ALP. Je to tmavo šedá pevná látka alebo, ak je veľmi čistá, žltá. Je to mimoriadne toxická zlúčenina pre živé bytosti.
Hliníkový fosfuro reaguje s vlhkosťou za vzniku fosfínu alebo pH fosfano3, čo je jedovatý plyn. Z tohto dôvodu by ALP nemal kontaktovať vodu. Silne reaguje s alkalickými kyselinami a roztokmi.
 Hliníkovo fosfid. Léمان [gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Zdroj: Wikimedia Commons.
Hliníkovo fosfid. Léمان [gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Zdroj: Wikimedia Commons. V minulosti sa použil na odstránenie škodcov, ako je hmyz a hlodavce, v miestach, kde sa ukladali obilné zrná a iné poľnohospodárske výrobky. Avšak kvôli svojmu vysokému nebezpečenstvu je vo väčšine krajín sveta zakázaný.
V súčasnosti sa jeho užitočnosť v oblasti elektroniky teoreticky skúma prostredníctvom počítačov, ktoré vypočítavajú možnosť získania polovodičových nanotrubíc ALP, tj mimoriadne malé trubice, ktoré môžu prenášať elektrinu iba za určitých podmienok.
Hliníkový fosfuro je veľmi nebezpečná zlúčenina, musí sa s ňou manipulovať s bezpečnostnými náradím, ako sú rukavice, šošovky, dýchacie zariadenie a ochranné oblečenie.
[TOC]
Štruktúra
ALP hliníkový fosfuro je tvorený spojením atómu hliníka v atóme fosforu P p. Prepojenie medzi nimi je kovalentné a trojnásobné, preto je veľmi silné.
Hliník v ALP má oxidačný stav +3 a fosfor má valenciu -3.
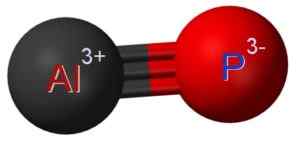 Hliníková fosfuro štruktúra, kde môžete vidieť trojité spojenie medzi atómami hliníka (AL) a fosforu (P) (P). Claudio pistilli [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Hliníková fosfuro štruktúra, kde môžete vidieť trojité spojenie medzi atómami hliníka (AL) a fosforu (P) (P). Claudio pistilli [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Menovanie
- Hliníkovo fosfid
Vlastnosti
Fyzický stav
Tmavošedá kryštalická pevná alebo tmavo žltá. Kubické kryštály.
Molekulová hmotnosť
57 9553 g/mol
Bod topenia
2550 ° C
Hustota
2,40 g/cm3 pri 25 ° C
Rozpustnosť
Rozkladá sa vo vode.
Chemické vlastnosti
Reaguje s vlhkosťou, čím poskytne fosfín alebo fosfano pH3 čo je horľavá a jedovatá zlúčenina. Fosfaan.
Môže vám slúžiť: gadolinio: štruktúra, vlastnosti, získanie, použitieHliníková fosfuro reakcia s vodou je nasledujúca:
Hliník fosfuro + voda → hydroxid hliniaka + fosfín
ALP + 3 h2O → TO (OH)3 + PH3↑
Obchodné prezentácie majú uhličitan hliník na2(CO3)3 Aby sa zabránilo sebaprinálu fosfínu, ktorý sa vyskytuje, keď ALP príde do kontaktu s vlhkosťou vzduchu.
ALP je stabilný, keď je suchý. Násilne reaguje s alkalickými kyselinami a roztokmi.
ALP hliníkový fosfuro sa neroztaví, ani sublimálne alebo sa tepelne rozkladá pri teplotách až 1000 ° C. Dokonca aj pri tejto teplote je jeho tlak pary veľmi nízky, to znamená, že sa pri tejto teplote neodparie.
Keď sa zahrieva na jeho rozklad emituje toxické oxidy fosforu. V kontakte s kovmi môžete emitovať horiace vodíkové plyny h2.
Ďalšie vlastnosti
Ak je čistý, vykazuje žltkasté sfarbenie, keď sa zmieša so zvyškami prípravnej reakcie, predstavuje farbu od šedej po čiernu farbu.
Jeho nízka volatilita vylučuje, že má vôňu, takže vôňa cesnaku, ktorá niekedy emituje, je spôsobená pH fosfínu3 ktorá sa tvorí v prítomnosti vlhkosti.
Získanie
Hliníkový fosfuro sa dá získať zahrievaním zmesi kovového prášku z hliníka (AL) a prvku červeného fosforu (P).
V dôsledku afinity fosforu (p) kyslíkom (alebo2) a hliník (al) kyslíkom a dusíkom (n2), Reakcia sa musí vykonávať vo voľnej atmosfére týchto plynov, ako je napríklad vodíková atmosféra (H2) alebo zemný plyn.
Reakcia začína rýchlo zahrievaním oblasti zmesi, až kým sa nezačne reakcia, ktorá je exotermická (v tom istom sa vyskytuje teplo). Od tejto chvíle reakcia prebieha rýchlo.
Hliník + fosfor → fosfuro hliníka
4 až + P4 → 4 ALP
Žiadosti
Pri odstraňovaní škodcov (prerušené použitie)
Hliníkový fosfuro sa v minulosti použil ako insekticíd a hlodavca. Aj keď ju však toxicita zakázala, stále sa používa v niektorých častiach sveta.
Môže ti slúžiť: .Kyselina stearová (CH3 (CH2) 16COOH): Štruktúra, vlastnosti, použitiaPoužíva sa na fumigáciu v uzavretých priestoroch, kde sa nachádzajú spracované alebo nespracované potravinové výrobky (napríklad obilniny), potraviny pre živočíšne a nepodoriace výrobky.
Cieľom je ovládať hmyz a hlodavce, ktoré útočia na uložené články, či už jedlé alebo nie.
Umožňuje kontrolu hlodavcov a hmyzu v nečistých, poľnohospodárskych alebo poľnohospodársky.
 Potkany a myši sú škodcovia, ktorí útočia na miesta skladovania obilnín. Pred niekoľkými rokmi sa bojovali s hliníkovým fosfuro. Autor: Andreas n. Zdroj: Pixabay.
Potkany a myši sú škodcovia, ktorí útočia na miesta skladovania obilnín. Pred niekoľkými rokmi sa bojovali s hliníkovým fosfuro. Autor: Andreas n. Zdroj: Pixabay.  Hlodavce boli riadené umiestnením hliníkového fosfuro do svojich nory. Autor: Foto-Rabe. Zdroj: Pixabay.
Hlodavce boli riadené umiestnením hliníkového fosfuro do svojich nory. Autor: Foto-Rabe. Zdroj: Pixabay. Jeho forma použitia spočíva v expozícii ALP vo vzduchu alebo vlhkosti, pretože sa uvoľňuje fosfínové alebo fosfaanské pH3 ktorý spôsobuje poškodenie mnohých morových orgánov na odstránenie.
 Hmyz bol tiež eliminovaný fosfuro hliníkom ALP. Autor: Michael Power. Zdroj: UNSPASH.
Hmyz bol tiež eliminovaný fosfuro hliníkom ALP. Autor: Michael Power. Zdroj: UNSPASH. V iných aplikáciách
ALP hliníkový fosfuro sa používa ako zdroj fosfínu alebo fosfano pH3 a používa sa v polovodičovom výskume.
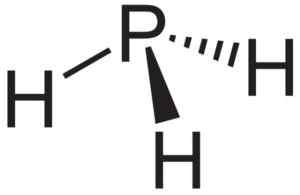 Fosfaano alebo fosfínové pH3, zlúčenina, ktorá sa tvorí, keď sa fosfuro hliníka ALP dostane do kontaktu s vodou. Neuroteker [verejná doména]. Zdroj: Wikimedia Commons.
Fosfaano alebo fosfínové pH3, zlúčenina, ktorá sa tvorí, keď sa fosfuro hliníka ALP dostane do kontaktu s vodou. Neuroteker [verejná doména]. Zdroj: Wikimedia Commons. Teoretický výskum nanotrubíc ALP
Uskutočnili sa teoretické štúdie o tvorbe nanotrubíc fosfuro hliníka ALP. Nanotrubice sú veľmi malé a veľmi tenké valce, ktoré môžu byť viditeľné iba pomocou elektronického mikroskopu.
ALP nanotrubice s bórom
Teoretické štúdie vykonávané prostredníctvom výpočtových výpočtov ukazujú, že nečistoty, ktoré by sa mohli pridať do nanotrubí ALP, by mohli zmeniť teoretické vlastnosti týchto.
Odhaduje sa napríklad, že pridanie atómov bóru (B) do nanotrubíc ALP by ich mohlo zmeniť na polovodiče typu-p. Polovodič je materiál, ktorý sa správa ako vodič elektrickej energie alebo ako izolácia v závislosti od elektrického poľa, do ktorého je vystavená.
Môže vám slúžiť: Plazmový stav: Charakteristiky, typy a príkladyA polovodič typu-p Je to, keď sa materiál pridáva nečistoty, v tomto prípade je ALP východiskovým materiálom a atómy bóru by boli nečistoty. Polovodiče sú užitočné pre elektronické aplikácie.
ALP nanotrubice so zmenenou štruktúrou
Niektorí vedci vykonali výpočty na určenie účinku zmeny štruktúry kryštalickej siete nanorúrok ALP z hexagonálneho na oktaedrálne.
Zistili, že manipulácia so štruktúrou kryštalickej siete by sa mohla použiť na úpravu vodivosti a reaktivity nanotrubičiek ALP a ich navrhovanie tak, aby boli užitočné pre elektroniku a optické aplikácie.
Riziká
Kontakt s hliníkovým fosfuro môže dráždiť pokožku, oči a sliznice. Ak je požitý alebo vdýchnutý, je toxický. Môže sa absorbovať cez pokožku s toxickými účinkami.
Ak ALP prichádza do kontaktu s vodou, reaguje a fosfínová forma alebo pH fosfánu3 Čo je mimoriadne horľavé, pretože horí v kontakte so vzduchom. Preto môže využiť. Okrem toho fosfín spôsobuje smrť ľudí a zvierat.
Pretože ekonomický pesticíd je hliníkový fosfuro, jeho používanie je bežnou príčinou otravy ľudí a znamená vysokú úmrtnosť.
 Hliníkový fosfuro je mimoriadne nebezpečný. Autor: OpenClipart-vektory. Zdroj: Pixabay.
Hliníkový fosfuro je mimoriadne nebezpečný. Autor: OpenClipart-vektory. Zdroj: Pixabay. Reaguje s vlhkosťou slizníc a kyselinou hydrochlorovodíkovou HClou žalúdka tvoriaca veľmi toxický plyn pH fosfánu3. Preto sa inhaláciou a požitím vytvára fosfín v tele so smrteľnými účinkami.
Jeho požitie spôsobuje krvácanie gastrointestinálneho traktu, kardiovaskulárny kolaps, neuropsychiatrické poruchy, respiračné a zlyhanie obličiek za pár hodín.
ALP je veľmi toxický pre všetky pozemské a vodné zvieratá.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Hliník. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Sjögren, b. a kol. (2007). Hliník. Ostatné hliníkové zlúčeniny. V príručke o toxikológii kovov (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Gupta, r.C. a Crissman, J.W. (2013). Hodnotenie bezpečnosti vrátane súčasných a vznikajúcich problémov v patológii toxikológie. Ľudské riziko. V Haschek a Rousseaux's Handbook of Toxikológia patológia (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Biela, w.A. a Bushey,.H. (1944). Hliníkový fosfid - príprava a zloženie. Journal of American Chemical Society 1944, 66, 10, 1666-1672. Získané z krčiem.ACS.orgán.
- Mirzaei, Maryam a Mirzaei, Mahmoud. (2011). Teoretická štúdia nanotrubíc fosfidov hliníka bóru. Výpočtová a teoretická chémia 963 (2011) 294-297. Zotavené z vedeckých pracovníkov.com.
- Takahashi, l. A Takahashi, K. (2018). Ladenie elektronickej štruktúry nanotrubičiek hliníka fosfidu. Appl. Nano mater. 2018, 1, 501-504. Získané z krčiem.ACS.orgán.
- Gupta, P.Klimatizovať. (2016). Toxické účinky pesicidov (agrochemikálie). Hliník. Vo fondoch toxikológie. Zotavené z vedeckých pracovníkov.com.
- « Obdĺžnikové súradnice príklady a cvičenia vyriešené
- Stupeň polynómu, ako sa určuje, príklady a cvičenia »

