Absorpčné spektrum

- 2471
- 784
- Ing. Ervín Petruška
 Spektrum viditeľného svetla. Zdroj: Wikimedia Commons
Spektrum viditeľného svetla. Zdroj: Wikimedia Commons Čo je absorpčné spektrum?
A Absorpčné spektrum Je to produkt interakcie svetla s materiálom alebo látkou v ktorejkoľvek z jeho fyzikálnych stavov. Interakcia obsahuje široký segment rozsahu vlnových dĺžok a energie elektromagnetického žiarenia.
Inými slovami, absorpčné spektrum odráža túto frakciu elektromagnetického žiarenia, ktorý určitý materiál absorbuje vo frekvenčnom rozsahu.
V tomto zmysle môžu niektoré tuhé látky, kvapaliny alebo plyny absorbovať fotóny rôznych energií alebo vlnových dĺžok, od ultrafialového žiarenia, po ktorom nasleduje viditeľné svetlo, po žiarenie alebo infračervené svetlo, ktoré sa ohromujú v mikrovlnných vlnových dĺžkach.
Ľudské oko vníma iba interakcie hmoty s viditeľným svetlom. Je tiež schopný uvažovať o difrakcii bieleho svetla prostredníctvom hranolu alebo média vo svojich farebných komponentoch (vynikajúci obraz).
Ak je svetelný lúč „chytený“ po prejdení materiálom a analyzovaný, nájdená neprítomnosť určitých farebných pásov by sa našla. To znamená, že čierne pruhy by sa pozorovali kontrastom s jeho pozadím.
Toto je absorpčné spektrum a jeho analýza je zásadná v inštrumentálnej analytickej chémii a astronómii.
Atómová absorpcia
Na hornom obrázku je zobrazené typické absorpčné spektrum prvkov alebo atómov. Všimnite si, že čierne pruhy predstavujú absorbované vlnové dĺžky, zatiaľ čo ostatné sú emitované. To znamená, že naopak, atómové vysielacie spektrum by vyzeralo ako čierna skupina s emitovanými farbami.
Ale čo sú to pruhy? Ako zistiť, či atómy absorbujú alebo emitujú (bez zavedenia fluorescencie alebo fosforescencie)? Odpovede sú v elektronických štátoch povolených atómami.
Môže vám slúžiť: Minimálny vzorec: Ako získať minimálny vzorec, príklady a cvičeniaElektronické prechody a energia
Elektróny sú schopné vzdialiť sa od jadra a pri cestovaní z orbitálu s nižšou energiou na jednu z väčších energie ho nechajú pozitívne načítané. Za týmto účelom, vysvetlené kvantovou fyzikou, absorbujú fotóny špecifickej energie na vykonanie uvedeného elektronického prechodu.
Preto je energia kvantifikovaná a nebude absorbovať stredné alebo tri štvrtiny fotónu, ale frekvenčné hodnoty (ν) alebo betónové vlnové dĺžky (λ).
Akonáhle je elektrón nadšený, nezostane neobmedzený v elektronickom stave väčšej energie. Uvoľniť energiu vo forme fotónu a atóm sa vracia do svojho bazálneho alebo pôvodného stavu.
V závislosti od toho, či sa zaznamenávajú absorbované fotóny, bude existovať absorpčné spektrum. A ak sa zaznamenajú vydané fotóny, výsledkom bude emisné spektrum.
Tento jav sa dá experimentálne pozorovať, ak sa z prvku zahrievajú mäkké alebo atomizované vzorky. V astronómii, porovnanie týchto spektier, môže byť známa zloženie hviezdy a dokonca aj jej umiestnenie súvisiace so Zemou.
Viditeľné spektrum
Ako je možné vidieť na obrázku, viditeľné spektrum obsahuje farby od fialovej po červenú a všetky jeho odtiene, pokiaľ ide o to, do akej miery materiál absorbuje (tmavé nuansy).
Vlnové dĺžky červeného svetla zodpovedajú hodnotám 650 nm ďalej (až do zmiznutia infračerveného žiarenia).
A na ľavom konci fialové a fialové tóny pokrývajú hodnoty vlnovej dĺžky do 450 nm. Viditeľné spektrum potom pokrýva od 400 do približne 700 nm.
Ako sa zvyšuje λ, frekvencia fotónu klesá, a teda aj jeho energia. Fialové svetlo má teda väčšiu energiu (nižšie vlnové dĺžky) ako červené svetlo (vyššie vlnové dĺžky).
Môže vám slúžiť: Bromín: História, štruktúra, elektronická konfigurácia, vlastnosti, použitiePreto materiál, ktorý absorbuje fialové svetlo, znamená elektronické prechody väčších energií.
Keď materiál absorbuje farbu fialovej, bude nosiť zelenkavú žltú farbu, čo znamená, že jej elektróny vykonávajú veľmi energetické prechody. A keď materiál absorbuje červenú farbu, menej energie, bude odrážať modrú zelenú farbu.
Ak je atóm veľmi stabilný, zvyčajne predstavuje veľmi vzdialené elektronické stavy v energii, a preto bude musieť absorbovať fotóny s väčšou energiou, aby sa umožnili elektronické prechody:
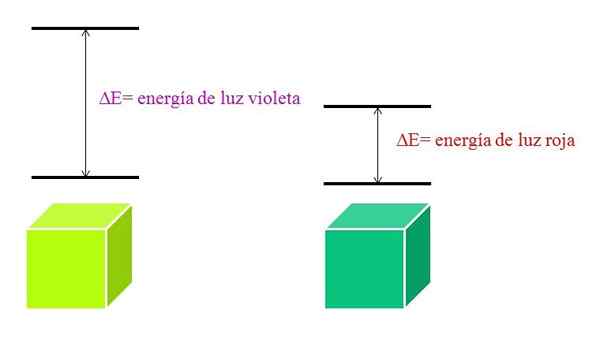 Schéma energie fialového svetla a červeného svetla. Zdroj: Gabriel Bolívar
Schéma energie fialového svetla a červeného svetla. Zdroj: Gabriel Bolívar Molekuly absorpčné spektrum
Molekuly majú atómy, ktoré tiež absorbujú elektromagnetické žiarenie. Ich elektróny sú však súčasťou chemickej väzby, takže ich prechody sú rôzne. Jedným z veľkých triumfov molekulárnej orbitálnej teórie je byť schopný spojiť absorpčné spektrá s chemickou štruktúrou.
Jednoduché, dvojité, trojité, konjugované spojenia a aromatické štruktúry majú teda svoje vlastné elektronické stavy, absorbujú veľmi špecifické fotóny.
Vlastnením niekoľkých atómov, okrem intermolekulárnych interakcií a vibrácií ich väzieb (ktoré tiež absorbujú energiu), majú molekuly absorpčné spektrá tvar „hôr“, ktoré označujú pásy, ktoré obsahujú vlnové dĺžky, kde elektronické prechody.
Vďaka týmto spektrám možno zlúčeninu charakterizovať, identifikovať a dokonca aj prostredníctvom multivariačnej analýzy ju kvantifikovať.
Metólska modrá
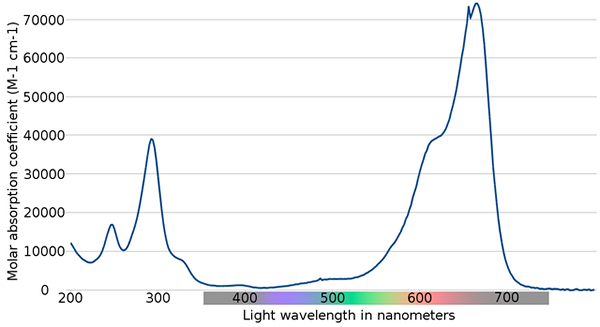 Spektrum metylénovej modrej. Zdroj: Wikimedia Commons
Spektrum metylénovej modrej. Zdroj: Wikimedia Commons Na hornom obrázku je zobrazené spektrum indikátora modrého metylénu. Ako ukazuje názov, je modrý, ale dá sa skontrolovať pomocou svojho absorpčného spektra?
Môže vám slúžiť: fyzické zmenyVšimnite si, že medzi vlnovými dĺžkami 200 a 300 nm sú pásy. Medzi 400 a 500 nm nie je takmer žiadna absorpcia, to znamená, že neabsorbuje fialovú, modrú alebo zelenú farbu.
Predstavuje však intenzívny absorpčný pás po 600 nm, a preto má nízkoenergetické elektronické prechody, ktoré absorbujú fotóny červeného svetla.
V dôsledku toho, a vzhľadom na vysoké hodnoty molárnych absorbít, metylénová modrá vykazuje intenzívnu modrú farbu.
Chlorofily a a b
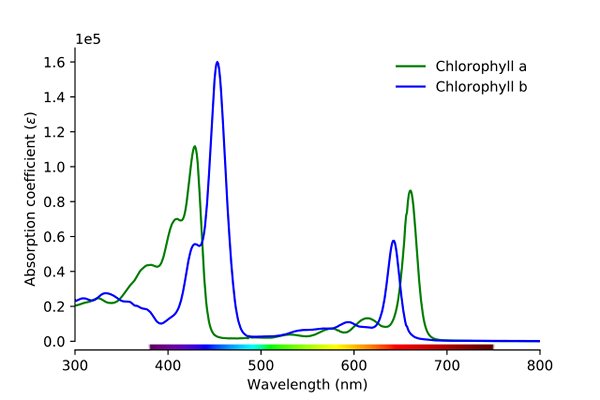 Chlorofyl absorpčné spektrum A a B. Zdroj: Wikimedia Commons
Chlorofyl absorpčné spektrum A a B. Zdroj: Wikimedia Commons Ako je možné vidieť na obrázku, zelená čiara zodpovedá chlorofylu absorpčné spektrum, zatiaľ čo modrá čiara zodpovedá spekaniu chlorofylu B.
Po prvé, pásma, kde sú molárne absorbiaty vyššie, v tomto prípade tie, ktoré sú vľavo, medzi 400 a 500 nm. Chlorofyl intenzívne absorbujúce fialové farby, zatiaľ čo chlorofyl B (modrá čiara) to robí s modrou farbou.
Absorbovaním chlorofylu B okolo 460 nm (modrá) sa odráža žltá farba. Na druhej strane tiež intenzívne absorbuje asi 650 nm, pomarančové svetlo, čo znamená, že vykazuje farbu modrej. Ak sú žlté a modré zmiešané, má za následok zelenú farbu.
A nakoniec, chlorofyl absorbuje moderú farbu fialovej farby a tiež červené svetlo okolo 660 nm. Preto vykazuje zelenú „mäkkú“ farbu žltou farbou.
Odkazy
- Obserdatoire de Paris (s.F.). Rôzne druhy spektier. Získané v priemere4.Osud.fr
- Ranals University Campus (S.F.). Spektrofometria: Absorpčné spektrá a kolorimetrická kvantifikácia biomolekúl. UCO sa zotavila.je

