Link
- 3336
- 331
- Denis Škriniar
Vysvetľujeme, čo je to PI Link, ako sa tvoria jeho charakteristiky, a uvádzame niekoľko príkladov
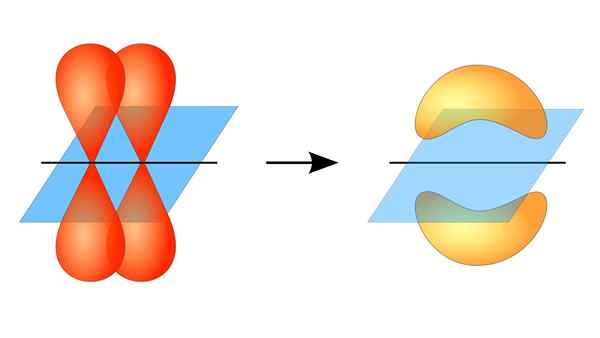
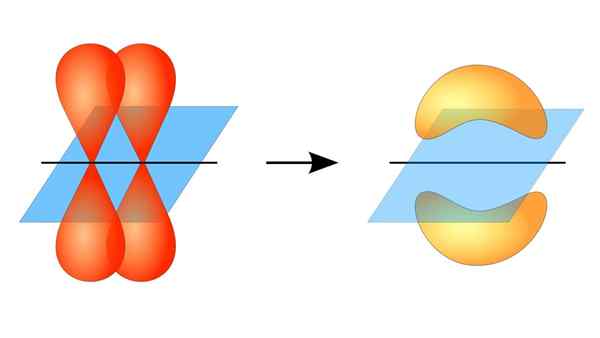 Dva orbitály P tvoriace spojenie π
Dva orbitály P tvoriace spojenie π Čo je to PI Link?
A Link (π) Je to kovalentný typ spojenia charakterizovaného zabránením pohybu atómov voľnej rotácie a pôvodom medzi párom čistých atómových orbitálov, medzi inými zvláštnosťami. Existujú odkazy, ktoré môžu byť medzi atómami vytvorené ich elektrónmi, ktoré im umožňujú vytvárať väčšie a zložitejšie štruktúry: molekuly.
Tieto odkazy môžu mať rôzne odrody, ale najbežnejšie v tejto oblasti štúdie sú kovalentné. Kovalentné väzby, tiež nazývané molekulárne, sú typom spojenia, v ktorom sa atómy zdieľajú páry elektrónov.
Môže sa to vyskytnúť v dôsledku potreby atómov hľadať stabilitu, čím sa vytvára väčšina známych zlúčenín. V tomto zmysle môžu byť kovalentné väzby jednoduché, dvojité alebo trojnásobné, v závislosti od konfigurácie ich orbitálov a množstva elektrónových párov zdieľaných medzi zúčastnenými atómami.
Z tohto dôvodu existujú dva typy kovalentnej väzby, ktoré sa tvoria medzi atómami na základe orientácie ich orbitálov: spojenia sigma (σ) a spojenia PI (π) (π).
Je dôležité rozlíšiť obe odkazy, pretože Sigma Link je prezentované v jednoduchých odboroch a PI vo viacerých odboroch medzi atómami (zdieľajú sa dva alebo viac elektrónov).
Ako je to formuláre Link Pi?
Aby sa opísala tvorba odkazu PI, malo by sa najprv diskutovať o procese hybridizácie, pretože zasahuje do niektorých dôležitých odkazov.
Hybridizácia je proces, v ktorom sa tvoria hybridné elektronické orbitály; to znamená, kde sa môžu zmiešať atómové orbitály sub -stupňov. To spôsobuje tvorbu orbitálov SP, SP2 a SP3, ktoré sa nazývajú hybridy.
Môže vám slúžiť: RETVERNA REAKCIA: Charakteristiky a príkladyV tomto zmysle k tvorbe odkazov PI dochádza vďaka prekrývaniu niekoľkých lalokov patriacich k atómovému orbitovi na inom páre lalokov, ktoré sú v orbitáli, ktorá je súčasťou iného atómu.
Toto orbitálne prekrývanie sa vyskytuje laterálne, takže elektronická distribúcia je koncentrovaná väčšinou nad a pod rovinou, ktorá tvorí prepojené atómové jadrá, a spôsobuje, že PI väzby sú slabšie ako Sigma Bonds.
Keď hovoríme o orbitálnej symetrii tohto typu Únie, treba spomenúť, že sa rovná symetrickému symetriu typu p typu P, pokiaľ sa pozoruje cez os vytvorenú odkazom. Okrem toho sú tieto odbory väčšinou tvorené orbitálmi P.
Tvorba väzieb PI u rôznych chemických druhov
Keďže PI Bonds sú vždy sprevádzané jedným alebo dvoma ďalšími odkazmi (jeden sigma alebo druhý pi a jeden sigma), je dôležité vedieť, že dvojitá väzba, ktorá sa vytvára medzi dvoma atómami uhlíka (vytvorená väzbou sigma a jedným PI) má nižšiu energiu prepojenia, ako je energia, ktorá zodpovedá dvojnásobnému spojeniu Sigma medzi nimi.
Toto sa vysvetľuje stabilitou Sigma Link, ktorá je väčšia ako stabilita PI Bond, pretože prekrývanie atómových orbitálov v posledne menovanom sa vyskytuje paralelne v oblastiach nad a pod lalokami, akumulujú elektronické rozdelenie ďalej jadro.
Napriek tomu, keď sú odkazy PI a Sigma kombinované viacnásobným hlasnejším odkazom ako samotným jednoduchým odkazom, ktorý je možné overiť pozorovaním dĺžky odkazu medzi rôznymi atómami s jednoduchými a viacerými odkazmi.
Môže vám slúžiť: nemetalické oxidyExistujú niektoré chemické druhy, ktoré sú študované ich výnimočným správaním, ako sú koordinačné zlúčeniny s kovovými prvkami, v ktorých sú centrálne atómy spojené iba pomocou PI Bonds.
Charakteristiky PI Link
Neumožňuje pohyb atómov voľného rotácie
Charakteristiky, ktoré odlišujú spojenie PI od iných druhov interakcií medzi atómovými druhmi. Z tohto dôvodu, ak dôjde k rotácii atómov, dôjde k prasknutiu väzby.
Prekrývanie sa medzi orbitálmi cez dve paralelné oblasti
Podobne, v týchto prepojeniach sa prekrývanie medzi orbitálmi vyskytuje prostredníctvom dvoch paralelných oblastí, vďaka čomu majú väčšiu difúziu ako Sigma Bonds a že z tohto dôvodu sú slabšie.
Medzi niekoľkými čistými atómovými orbitálmi
Na druhej strane, ako je uvedené vyššie, spojenie PI je vždy generované medzi párom čistých atómových orbitálov; Tento prostriedok sa vytvára medzi orbitálmi, ktoré netrpeli hybridizačné procesy, v ktorých je hustota elektrónov väčšinou koncentrovaná nad a pod rovinou tvorenou kovalentnou úniou.
V tomto zmysle je možné prezentovať viac ako jedno spojenie PI medzi niekoľkými atómami, ktoré sú vždy sprevádzané Sigma Link (v dvojitých väzbách).

Podobne môžete dať trojité spojenie medzi dvoma susednými atómami, ktoré sú tvorené dvoma väzbami PI v pozíciách, ktoré navzájom tvoria kolmé roviny, a Sigma spojenie medzi týmito dvoma atómami.
Môže vám slúžiť: kyselina humíková: štruktúra, vlastnosti, získanie, použitiePríklady odkazov PI
Molekula etylénu
Ako už bolo uvedené, molekuly tvorené zjednotenými atómami jednou alebo viacerými PI väzbami majú vždy viacnásobné spojenia; to znamená dvojitý alebo trojitý.
Príkladom je molekula etylénu (h2C = ch2), ktorý predstavuje dvojitá únia; To znamená, že PI a jedna sigma väzba medzi svojimi atómami uhlíka, okrem Sigma väzieb medzi uhlíkmi a hydrogénmi.
Acetylénová molekula
Molekula acetylénu (H-C≡C-H) má trojnásobné spojenie medzi atómami uhlíka; To znamená, že dve väzby PI tvoriace kolmo a väzbu Sigma, okrem zodpovedajúcich väzieb uhlíka-hydrogén.
Benzén a deriváty
Uvádzajú sa aj PI väzby medzi cyklickými molekulami, ako je benzén (C6H6) a jeho deriváty, ktorých dispozícia má za následok účinok nazývanú rezonancia, ktorá umožňuje migrovať elektronickú hustotu medzi atómami a udeľovať okrem iného väčšiu stabilitu zlúčeniny.
Dikarbón
Na príklad skôr uvedených výnimiek, prípady dikarbonálnej molekuly (C = C, v ktorých majú oba atómy pár párových elektrónov) a koordinačnú zlúčeninu nazývanú Hexacarbonildihierro (predstavuje ako viera ako viera2(CO)6, ktorý tvorí iba PI odkazy medzi jeho atómami).

