Chlorid stroncia (SRCL2)
- 3947
- 206
- JUDr. Rudolf Čapkovič
Čo je to Stroncium chlorid?
On Chlorid strontium Je to anorganická zlúčenina tvorená strontium, alkalinoterreo kov (SR. Beamgbara) a halogén chlóru. Pretože oba prvky majú veľmi odlišné elektronegativity, zlúčenina je iónová tuhá látka, ktorej chemický vzorec je SRCL2.
Rovnako ako iónová tuhá látka, je tvorená iónmi. V prípade SRCL2, Sú to katión2+ Pre každé dva anióny Cl-. Jeho vlastnosti a aplikácie sú podobné ako chlorid vápnika a bária.
Ako chlorid vápenatý (CACL2) je hygroskopický a jej kryštály absorbujú vodu za vzniku hexahydrátovej soli, v ktorej je v kryštalickej mriežke prítomných šesť molekúl vody (SRCL2· 6h2Buď). V skutočnosti je dostupnosť hydrátu väčšia ako SRCL2 bezvodý (bez vody).
Jednou z jej hlavných aplikácií je predchodca iných zlúčenín stroncia; to znamená, že v určitej chemickej syntéze predstavuje zdroj stroncia.
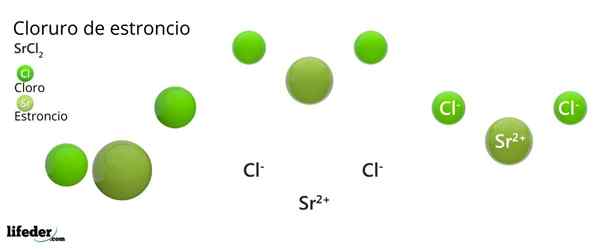
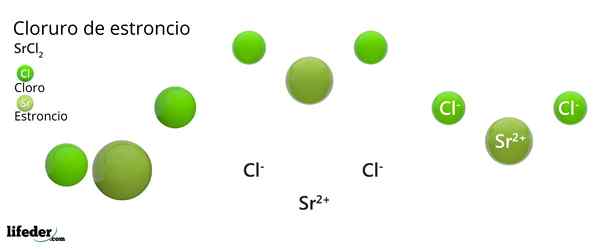
Chemická štruktúra chloridu stroncia
 Kryštalická štruktúra chloridu stronta
Kryštalická štruktúra chloridu stronta Vynikajúci obrázok predstavuje kryštalický typ štruktúry zdeformovaného SRCL2 bezvodý. V tomto, malé zelené gule zodpovedajú SR iónom2+, Zatiaľ čo objemné zelené gule predstavujú ióny CL-.
V tejto štruktúre každý sr ión2+ Je „uväznený“ ôsmimi iónmi-, V dôsledku toho má koordinačné číslo rovné 8 a prípadne kubická geometria okolo nej. To znamená, že štyri zelené gule vytvárajú strechu kocky, zatiaľ čo ďalšie štyri podlahy sa nachádzajú SR2+ V jeho strede.
Čo by bola štruktúra sódy fázy? Štruktúra Lewisa pre túto soľ je CL-SR-CL, zjavne lineárna a za predpokladu, že sto percent jej prepojení. Avšak v plynnej fáze -SRCL2(G)- Táto „čiara“ vykazuje uhol približne 130 °, v skutočnosti je to druh V.
Môže vám slúžiť: plynný stav: Charakteristiky, všeobecné právo, príkladyTúto anomáliu nebolo možné úspešne vysvetliť, berúc do úvahy skutočnosť, že stroncium nezdieľa elektróny, ktoré zaberajú elektronický objem. Možno to môže byť spôsobené účasťou orbitálnej d v odkazoch alebo poruchou jadra a elektrónu.
Použitie/aplikácie chloridu strontium
SRCL2· 6h2Alebo sa používa ako prísadka v organických polyméroch; Napríklad v polyvinylalkoholu s cieľom modifikovať jeho mechanické a elektrické vlastnosti.
Používa sa ako strontium feritu pri výrobe keramických a sklenených magnetov určených na výrobu predného kryštálu televízie.
Reaguje s chromatom sodným (Na2CRO4) na výrobu stronciového chromátu (SRCRO4), ktorá sa používa ako farba odolná voči korózii pre hliník.
Keď sú zahrievané ohňom, stronciové zlúčeniny žiaria červenkastým plameňom, a preto sú predurčené k vypracovaniu svetlice a ohňostrojov.
Liečivé aplikácie
Rádioizotop strontium chlorid 89 (najhojnejším izotopom je 85Pán.
Použitie zriedených roztokov (3-5 %) na viac ako dva týždne pri liečbe alergickej rinitídy (chronický zápal nosnej sliznice) vykazuje zlepšenie znižovania kýchania a nosného trenia.
Akonáhle sa použil v formuláciách dentifrických pastov na zníženie citlivosti zubov, čím sa vytvorila bariéra na dentinálnych mikrotubuloch.
Štúdie tejto zlúčeniny demonštrujú terapeutickú účinnosť v porovnaní s prednizolónom (prednisónový metabolit liečiva) pri liečbe ulceróznej kolitídy.
Môže vám slúžiť: Molárna frakcia: Ako sa vypočítava, príklady, cvičeniaJeho výsledky sú založené na modeli potkanov; Napriek tomu predstavuje nádej pre tých pacientov, ktorí tiež trpia osteoporózou, pretože môžu ísť na rovnaké lieky na boj proti týmto dvom chorobám.
Používa sa na syntézu sulfátu stroncia (SRSO4), ešte hustejšie ako SRCL2. Jeho minimálna rozpustnosť vo vode však neznamená, že je dostatočne ľahká na to, aby sa mohla aplikovať v rádiológii, na rozdiel od síranu bária (BASO4).
Príprava chloridu stroncia
Chlorid stroncia sa môže pripraviť priamym pôsobením kyseliny chlorovodíkovej (HCI) na čistý kov, čím sa vyskytuje reakcia redoxného typu:
MR (s) + HCl (ac) => srcl2(Ac) + h2g)
Tu je kov strontium oxidovaný darovaním dvoch elektrónov, aby sa umožnila tvorba plynného vodíka.
Tiež hydroxid a uhličitan strontium (SR (OH)2 a SRCO3) reagovať s touto kyselinou syntézou:
SR (OH)2(s) + 2HCl (ac) => srcl2(Ac) + 2h2Alebo (l)
SRCO3(s) + 2HCl (ac) => srcl2(ac) + co2g) + h2Alebo (l)
Aplikácia techník kryštalizácie sa získa SRCL2· 6h2Ani. Po dehydratovaní tepelným pôsobením, až kým SRCL konečne produkuje2 bezvodý.
Vlastnosti stroncia chlorid
Fyzikálne a chemické vlastnosti tejto zlúčeniny závisia od toho, či je v hydratovanej alebo bezvodej forme. Je to preto, že elektrostatické interakcie sa menia, keď sa k kryštalickej mriežke SRCL pridávajú molekuly vody2.
Bezvodý
Chlorid strontium je biela kryštalická tuhá látka s molekulovou hmotnosťou 158,53 g/mol a hustotou 3,05 g/ml.
Jeho topiace sa body (874 ° C) a varenie (1250 ° C) sú vysoké, čo svedčí o silných elektrostatických interakciách medzi SR iónmi2+ a cl-. Odráža tiež veľkú kryštalickú retikulárnu energiu, ktorú má jej bezvodá štruktúra.
Môže vám slúžiť: octanu celulózyEntalpia formácie SRCL2 tuhá látka je 828,85 kJ/mol. Vzťahuje sa na tepelnú energiu uvoľnenú každým krtom tvoreným z jej komponentov vo svojich štandardných stavoch: chlór a pevný plyn pre stroncium.
Hexahydrát
Vo forme hexahydrátu má vyššiu molekulovú hmotnosť ako jeho bezvodý (267 g/mol) tvar a nižšiu hustotu (1,96 g/ml). Toto zníženie jeho hustoty je spôsobené skutočnosťou, že molekuly vody „rozširujú“ kryštály, čím sa zvyšuje objem; Preto hustota štruktúry klesá.
Je takmer dvakrát hustá ako voda pri izbovej teplote. Jeho rozpustnosť vo vode je veľmi vysoká, ale v etanole je mierne rozpustný. Je to kvôli jeho organickému charakteru napriek jeho polarite. To znamená, že hexahydrát je anorganická polárna zlúčenina. Nakoniec, pri 150 ° C sa stane dehydratovaným, aby sa vytvorila bezvodá soľ:
Srcl2· 6h2Alebo (s) => srcl2(s) + 6h2O (g)
Odkazy
- Wikipedia. (2018). Chlorid strontium. Získaný z.Wikipedia.orgán
- Drogová banka. (2018). Stroncium chlorid SR-89. Droganka sa uzdravila.Ac
- Publikácia. (2018). Chlorid strontium. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda
- Býk. Mater. (2010). Vplyv granulovaného chloridu kamene ako prísad na submárne elektrické a mechanické vlastnosti pre čistý polyvinylalkohol. Sci., Zvuk. 33, nie. 2, pp. 149-155. Indická akadémia vied.
- Ccoil. (4. september 2009). Ston-chlorid -xtal-3D-SF. [Obrázok]. Získané 13. apríla 2018, od: Commons.Wikimedia.orgán
- Všetky reakcie. SRCL2 - chlorid z kameňa. Zotavené z Allreactions.com