Diastreoméry
- 1799
- 514
- Adrián Fajnor
Vysvetľujeme, čo sú diastoméry, ako sa uznávajú ich vlastnosti, nomenklatúra a niekoľko príkladov,
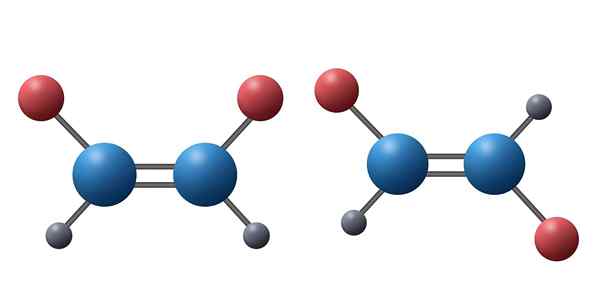
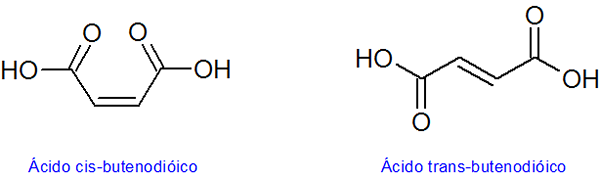
 Tieto dve alkény sú príkladom diastereomérov. Tu je zrejmé, že všetky atómy obidvoch molekúl sú zjednotené v rovnakej sekvencii a prostredníctvom rovnakých typov odkazov. V prvej zlúčenine sú však červené atómy na rovnakej strane, zatiaľ čo v druhej zlúčenine smerujú v opačných smeroch. Je zrejmé, že žiadny z nich nie je zrkadlom druhého
Tieto dve alkény sú príkladom diastereomérov. Tu je zrejmé, že všetky atómy obidvoch molekúl sú zjednotené v rovnakej sekvencii a prostredníctvom rovnakých typov odkazov. V prvej zlúčenine sú však červené atómy na rovnakej strane, zatiaľ čo v druhej zlúčenine smerujú v opačných smeroch. Je zrejmé, že žiadny z nich nie je zrkadlom druhého Čo sú diamereoméry?
Ten Diastreoméry, Tiež sa nazývajú diametereoizoméry, sú definované ako stereoizoméry, ktoré navzájom nie sú zrkadlové obrazy. Sú to konkrétny typ izomérov, čo znamená, že ide o rôzne zlúčeniny, ktoré zdieľajú rovnaký molekulárny vzorec.
Existujú rôzne typy izomérov, z ktorých sú stereoizoméry. Toto sú tie, v ktorých sú všetky atómy spojené v rovnakom poradí a s rovnakým typom odkazov, ale majú rôzne orientácie v priestore (stereo znamená priestor). V stereoizoméroch nachádzame diamereoméry, ktoré sa vyznačujú tým, že nie sú zrkadlovými obrazmi navzájom.
Inými slovami, diamereoméry sú Stereoizoméry taký Nie sú si navzájom enantioméry.
Existujú rôzne typy diastoméry.
Ako spoznáte diamereoméry?
Aby sme rozpoznali diastoméry, najprv určíme, či sú to cis-trans izoméry alebo či sú izoméry E-Z. Ak sa to stane, potom sú to diastereoméry. V opačnom prípade sa dodržiavajú nasledujúce pravidlá:
- Musia to byť stereoizoméry, to znamená, že sa musia líšiť iba v priestorovej orientácii svojich atómov.
- Musia mať dve alebo viac chirálnych centier.
- Musia mať rovnakú konfiguráciu aspoň v jednom zo svojich chirálnych centier.
- Musia mať opačnú konfiguráciu aspoň v jednom z ich chirarálnych centier.
Každý pár izomérov, ktoré spĺňajú tieto vlastnosti, bude pár diastereomérov.
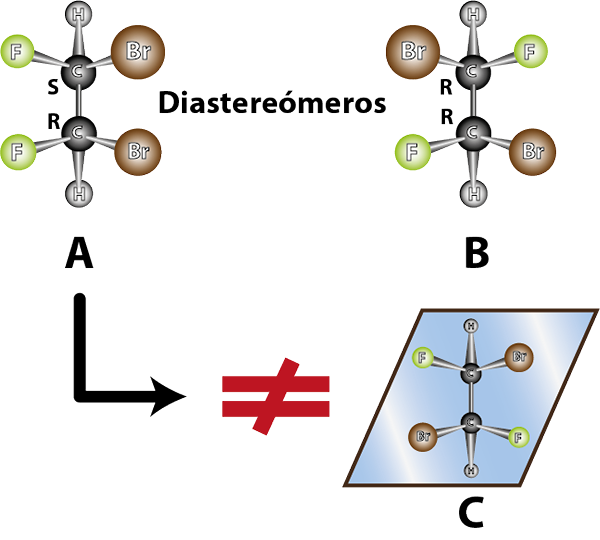 Zlúčeniny A a B sú diastoméry. Okrem toho A a B nie sú zrkadlové obrázky
Zlúčeniny A a B sú diastoméry. Okrem toho A a B nie sú zrkadlové obrázky Vlastnosti diastreomérov
Jeho fyzikálne a chemické vlastnosti sú rôzne
Na rozdiel od enantiomérov, ktoré zdieľajú rovnaký bod varu, fúziu atď., Diastreoméry sú celkom odlišné zlúčeniny a môžu mať veľmi odlišné fyzikálne a chemické vlastnosti.
Takmer vždy majú rozdiely vo svojej polarite, v tlaku pary, v ich bodoch varu a fúzie a dokonca aj v rozpustnosti v rôznych rozpúšťadlách.
Rozdiely vo svojich fyzikálnych a chemických vlastnostiach to umožňujú.
Môžu alebo možno
Môže byť viac dní tej istej zlúčeniny a niektoré z nich môžu byť chirálmi, zatiaľ čo iné nie, v závislosti od toho, či má molekula nejaký typ symetrie alebo nie.
Skutočnosť, že chirálne centrá nezabezpečia, aby bola molekula taká. Niektoré zlúčeniny s chirálnymi centrami môžu byť symetrické, takže budú superponovateľné so zrkadlovým obrazom, a preto nebudú chirals. V týchto prípadoch sa nazývajú Zlúčenina.
-
Príklad:
Nasledujúci obrázok zobrazuje dva diamereoméry kyseliny z kamerovej. Diastreomero A nie je chirálny, pretože ide o symetrickú molekulu (polovica zhora je odrazom nižšie). Avšak diamereomér B, ak je chirálny.
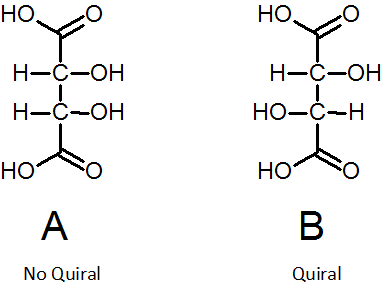
Na predchádzajúcom obrázku je izomér A príkladom mezo zlúčeniny.
Môžu to byť cis-trans a izoméry E-Z
CIS a trans izoméry, ako aj izoméry E-Z alkénu alebo nahradeného cyklu sú stereoizoméry, ktoré nie sú zrkadlovými obrazmi navzájom, takže sú to tiež diastereoméry.
Môže vám slúžiť: hexoquináza: štruktúry, funkcie, tvaryOptická činnosť
Tie diastoméry, ktoré majú chirarálne centrá, ale to nie sú zlúčeniny mezo, budú chirálne zlúčeniny, a preto budú opticky aktívne. To znamená, že sú schopní otočiť rovinu polarizovaného svetla.
Nomenklatúra diamereomérov
Nomenklatúra diamereomérov, ktoré majú chirálne centrá (tie, ktoré nie sú cis-trans alebo E-Z), je založená na systematickom názve IUPAC zlúčeniny predchádzajúcej absolútnou konfiguráciou každého chirálneho centra v poradí, v akom sa objavujú v hlavnom hlavnom reťaz.
Existuje niekoľko metód na identifikáciu jedného alebo druhého diastereoméru, ale najpoužívanejší je systém Cahn-Igold-Prelog (CIP). Pozostáva z nasledujúcich krokov:
- Hierarchii je priradená k štyrom skupinám pripojeným ku každému chirálnemu centru. Priorita skupín je priradená podľa atómového čísla atómu priamo spojeného s Quiral Center. Ak existujú dva rovnaké atómy, pridajú sa atómové čísla atómov, ktoré sú spojené s prvým.
- Smer, v ktorom sa prejdú tri prioritné skupiny.
- Ak je smer trasy v smere rúk hodín, je priradená konfigurácia R, inak je priradená konfigurácia S.
Príklad
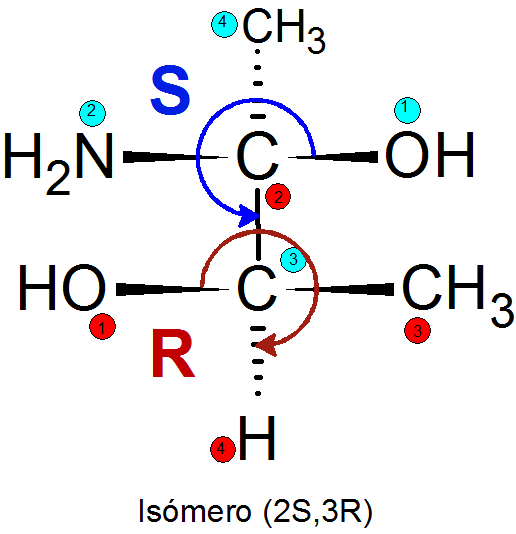
Príklady bežných diamereomérov
Príklady dní uhľohydrátov
Diastreoméry sú svojou povahou veľmi časté, najmä v zlúčeninách biologického významu. Ďalej sú uvedené rôzne dni troch dôležitých skupín cukrov ako príklady:
-
Diastreoméry La Ribosa
Ribosa je jedným z najdôležitejších sacharidov v prírode, pretože je súčasťou DNA aj RNA, ktorá tvorí náš genetický materiál. Tento uhľohydrát má tri chirálne centrá, ktoré vedú k ôsmim rôznym izomérom. Ďalej sú uvedení 4 najdôležitejší diaster tohto cukru:
Môže vám slúžiť: presýtené riešenie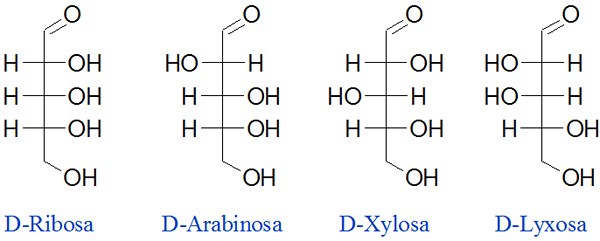
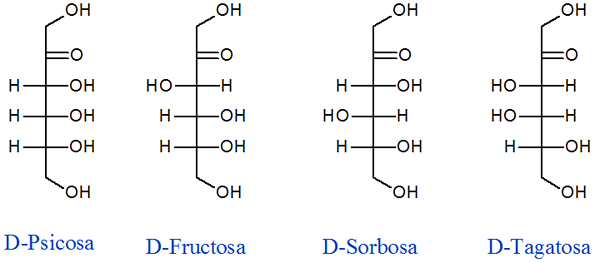
Fruktózové diastereoméry
Ako už názov napovedá, fruktóza je cukor nachádzajúci sa v ovocí a má tri chirálne centrá, ktoré vedú k nasledujúcim dňom
Glukózový diastereomér
Glukóza je najbežnejším uhľohydrátom, ktorý existuje a je jednou z najhojnejších biologických molekúl na celej Zemi. Celkom je 16 izomérov, z ktorých iba 8 je prítomných vo väčšine živých bytostí. Ďalších 8 je prítomných iba v niektorých bunkách. Nižšie je uvedených 8 najbežnejších diastomérov:
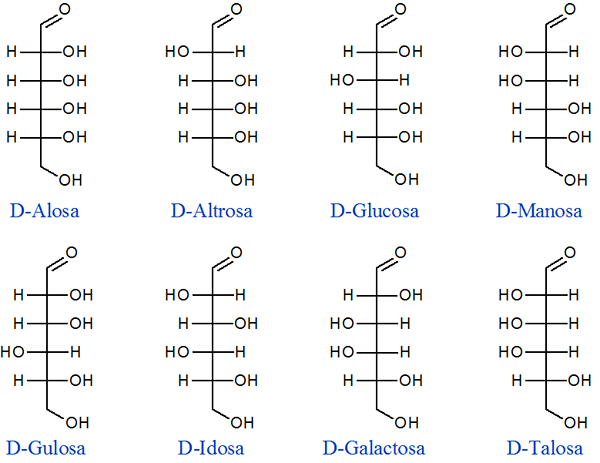
Môžeme poznamenať, že pri porovnaní akéhokoľvek páru diastomérov sa líšia v konfigurácii aspoň jedného chirálneho uhlíka a zdieľajú konfiguráciu aspoň jedného chirálneho uhlíka.
Príklad cis-trans diastereomérov
Príklad e-Z diastereomérov
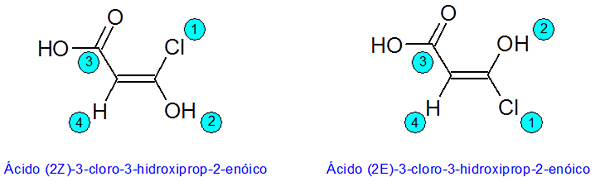
V tomto príklade zobrazené čísla zodpovedajú priorite substituentov podľa pravidiel systému CIP.
Odkazy
- Carey F. (2008). Organická chémia. (6. vydanie.). MC Graw Hill.
- Diastereomér. (2021). Merriam-webster.Com Dictionary, Merriam-Webster, Merriam-Webster.com
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Monosacharid. (16. februára 2021). Na Wikipédii.orgán.
- Nelson, D. L., & Cox, M. M. (2017). Lehninger princípy biochémie (7. vydanie.). W.H. Freeman.

