Enantioméry
- 839
- 92
- Alfréd Blaho
Vysvetľujeme, čo sú enantioméry a chiralita, ich vlastnosti, nomenklatúra a niekoľko príkladov
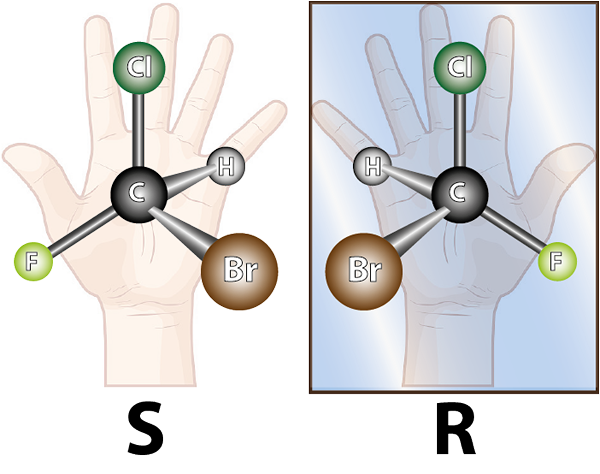
 Tieto dve zlúčeniny sú enantioméry, pretože sú tvorené rovnakými atómami, zjednotené rovnakým spôsobom a sú to
Tieto dve zlúčeniny sú enantioméry, pretože sú tvorené rovnakými atómami, zjednotené rovnakým spôsobom a sú to Čo sú enantioméry?
Ten enantioméry Sú to páry zlúčenín, ktoré sú navzájom nepretržité zrkadlové obrazy. Tieto páry zlúčenín sú osobitným typom izomérov, to znamená, že sú to rôzne zlúčeniny, ktoré majú rovnaký molekulárny vzorec.
Existujú rôzne typy izomérov, z ktorých sú stereoizoméry, v ktorých sú všetky atómy spojené v rovnakom poradí a s rovnakým typom odkazov, ale majú rôzne orientácie vo vesmíre (stereo znamená priestor).
V stereoizoméroch nachádzame enantioméry, ktorých hlavnou charakteristikou majú byť sekulárne obrázky medzi sebou.
Enantioméry sú svojou povahou veľmi bežné. V skutočnosti sú takmer všetky organické zlúčeniny prítomné v bunkách všetkých živých bytostí jedným z dvoch možných enantiomérov.
Napríklad všetky aminokyseliny, ktoré sú súčasťou prírodných proteínov, zodpovedajú enantioméru L príslušnej aminokyseliny (druhý izomér identifikuje s písmenom D).
Na druhej strane, aktívne zložky drvivej väčšiny liekov existujú aj ako páry enantiomérov, z ktorých iba jeden je účinný. Obtiažnosť pri oddeľovaní enantiomérov od seba znamená, že tie lieky, ktoré obsahujú iba užitočný izomér, sú veľmi drahé.
Enantioméry a chiralita
Enantioméry sú tvorené chirálnymi molekulami. Chiralita je vlastnosťou, že sa neprekrýva zrkadlový obraz. Slovo chiral pochádza z gréckeho termínu, Kheir čo znamená ruku, zapamätať si skutočnosť, že ruky sú tiež navzájom zrkadlové obrazy a nemôžu sa prekrývať.
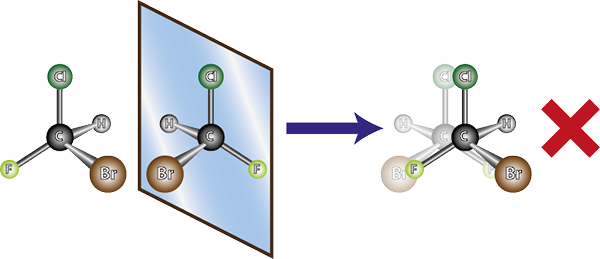 Molekula vľavo je chirálna, pretože pri jej porovnaní so zrkadlom je zrejmé, že sa neprekrývajú. Inými slovami, neexistuje spôsob, ako ho otáčať alebo otočiť tak, aby sa všetky atómy zhodovali medzi sebou
Molekula vľavo je chirálna, pretože pri jej porovnaní so zrkadlom je zrejmé, že sa neprekrývajú. Inými slovami, neexistuje spôsob, ako ho otáčať alebo otočiť tak, aby sa všetky atómy zhodovali medzi sebou Vzhľadom na vyššie uvedené sa dá odvodiť, že pre každú chirálnu molekulu musí existovať ďalšia chirálna molekula, ktorá je jej prekrývajúcim sa zrkadlovým obrazom, to znamená jeho enantiomér. Inými slovami, kedykoľvek sa hovorí molekula.
Môže vám slúžiť: Neodymium: Štruktúra, vlastnosti, použitieChirálne centrá
Mnoho chirálnych zlúčenín má jedno alebo viac asymetrických centier, ktoré sú zodpovedné za chiralitu molekuly. Tieto sa nazývajú chirálne centrá a v mnohých organických zlúčeninách pozostávajú z atómov uhlíka, ktoré sú spojené so 4 atómami alebo skupinami rôznych atómov.
Konkrétna forma, pretože tieto štyri skupiny sú distribuované okolo asymetrického uhlíka, určuje, ktorý z týchto dvoch enantiomérov zodpovedá chirálnej molekule. Prítomnosť jediného quirálneho centra zaisťuje, že molekula je chirálna, ale ak je viac ako jedna, môže byť chirálna, pretože nemusí.
Vlastnosti enontioméru
Väčšina fyzikálnych a chemických vlastností je rovnaká
Rovnako ako pravá ruka a ľavá ruka, enantioméry prichádzajú iba v pároch. Tieto zlúčeniny sú navzájom prakticky identické. V skutočnosti je väčšina jej fyzikálnych a chemických vlastností, ako je bod fúzie, varenie, tlak pary a rozpustnosť v niektorých rozpúšťadlách, sú okrem iného rovnaké.
Optická činnosť
Všetky chirálne zlúčeniny majú jedinečnú vlastnosť, ktorá ich odlišuje od tých, ktorí nie sú: majú schopnosť otáčať rovinu polarizovaného svetla. Táto vlastnosť sa volá Optická činnosť, A je to jedna z mála vlastností, ktorá odlišuje chirálnu zlúčeninu od jej enantioméru.
Posledne menovaná je spôsobená skutočnosťou, že polarizovaná rovina svetla sa môže otáčať v jednom z dvoch smerov, buď v smere k ihly s hodinami (nazývané dextrogyr a reprezentované so symbolom +) alebo proti ihlám s hodinami (Levógiro, reprezentované s. symbol -).
Ak királna zlúčenina otočí polarizovanú svetelnú rovinu v jednom smere, jej enantiomér ju otočí v opačnom smere.
-
Príklad
Roztok D-glucosa sa otáča polarizovanou svetlou rovinou v smere hodinových ihiel (vpravo, je dextrogyral), zatiaľ čo roztok L-glykózy sa otáča v opačnom smere.
Môže vám slúžiť: Erlenmeyer Bank: Charakteristiky, použitia, metódy použitiaDiferenciálna reaktivita
Ďalšou vlastnosťou, ktorá umožňuje rozlíšiť jeden enantión od druhej, je jej reaktivita proti iným chirálnym zlúčeninám.
Diferenciálna reaktivita sa dá porovnať so spôsobom, akým rukavica vyzerá dobre na jednej strane, ale nie druhej, alebo ako pravá topánka dobre zapadá do pravej nohy, ale nie doľava.
Dôležitým dôsledkom diferenciálnej reaktivity sú rôzne účinky, ktoré môžu spôsobiť dva enantioméry niektorých liekov. Tieto rozdiely môžu byť neškodné, ale môžu byť tiež veľmi nebezpečné.
-
Príklady
- Z dvoch enantimerov aspartamu (čo je umelé sladidlo), je jeden sladký, zatiaľ čo druhý nemá chuť.
- Iba enantiomér omeprazolu je účinný ako žalúdočný ochranca, zatiaľ čo druhý nemá žiadny účinok.
- D-Penicilamín je liek proti reumatoidnej artritíde, zatiaľ čo jeho enantiomér, L-Penicilamín je nebezpečný jed.
Diferenciálna absorpcia
Enantioméry sa tiež líšia v spôsobe, akým sú absorbované v živícoch alebo tuhých látkach, ktoré sú tiež chirálmi. Zmes enantiomérov sa môže oddeliť, ak prechádza cez stĺpec chirálnej separácie, pretože jeden z dvoch enantiomérov bude absorbovaný silnejšie ako druhý.
Nomenklatúra enantiomérov
Existuje niekoľko metód na identifikáciu jedného alebo druhého enantioméru, ale najpoužívanejším je systém Cahn-Igold-Prelog (CIP). Pozostáva z nasledujúcich krokov:
- Hierarchii je priradená k štyrom skupinám pripojeným ku každému chirálnemu centru. Priorita skupín je priradená podľa atómového čísla atómu priamo spojeného s Quiral Center. Ak existujú dva rovnaké atómy, pridajú sa atómové čísla atómov, ktoré sú spojené s prvým.
- Smer, v ktorom sa prejdú tri prioritné skupiny.
- Ak je smer trasy v smere rúk hodín, je priradená konfigurácia R, inak je priradená konfigurácia Siež.
Príklad
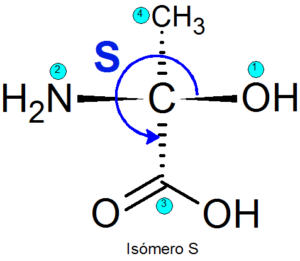
Príklady enantiomérov
D-glyceraldehyd a l-glyceraldehyd
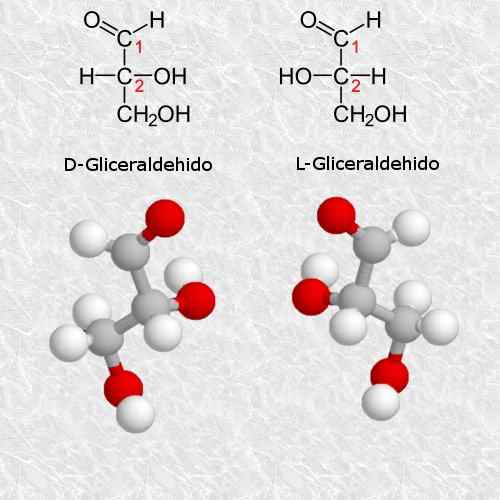
GlyceralDehyd je najjednoduchší a najmenší királny uhľohydrát, ktorý existuje a je veľmi dôležitý pre chémiu a biológiu.
Podľa pravidiel systému Cahn-Ingold-Prelog, I izomér zodpovedá izoméru (R) a L izomér zodpovedá písm. S) (S).
D-Alanina a L-Alanina
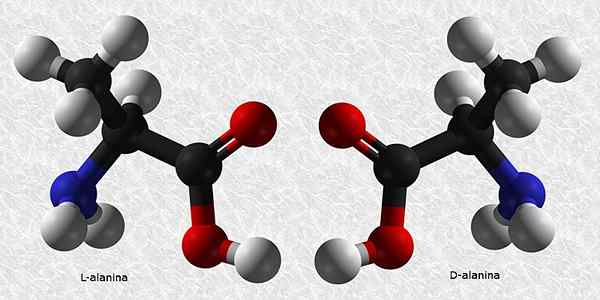
Alanín je jednou z esenciálnych aminokyselín pre konštrukciu proteínov. Rovnako ako takmer všetky aminokyseliny, má chirálny uhlík, takže má dva enantioméry:
Z týchto dvoch je L-Alanina najbežnejšia a je prítomná u všetkých živých bytostí, zatiaľ čo D-Alanina je prítomná iba v niektorých bakteriálnych bunkových stenách.
D-tartarická a kyselina L-tatarová
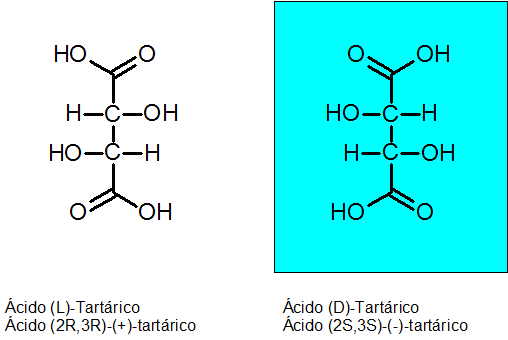
Chiralita objavil Louis Pasteur v roku 1848 vďaka kyseline zborovej. Táto zlúčenina má 2 asymetrické uhlíky a môže existovať ako dva enantioméry plus tretí izomér, ktorý sa nazýva mezo zlúčenina.
Absolútna konfigurácia týchto dvoch chirálnych uhlíkov je R pre Enantiómero Levógiro a S pre dextrogyan enantiom.
2-butanol
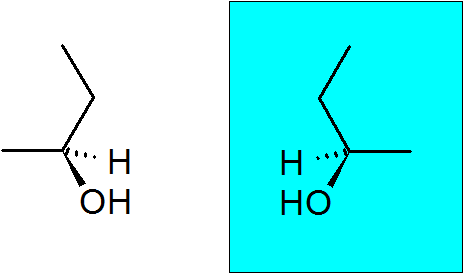
Tento alkohol má tiež királny uhlík, vďaka ktorému má táto zlúčenina dva enantioméry.
Bromokloroetán
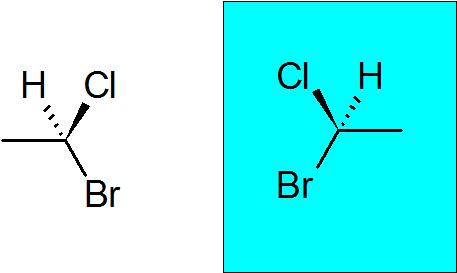
Je to veľmi jednoduchá chirálna zlúčenina s iba dvoma uhlím. Quirálny uhlík sa pripojil k brómu, chlóru, metylu a vodíku.
Odkazy
- Chiralita (chémia). (18. marca 2021), na Wikipédii.com
- Carey, f. Do. (2008). Organická chémia. Boston: McGraw-Hill Higher Education.
- Smith, m., Marec, j., & Marec, J. (2001). Advanced Organic Chemistry: Lac. New York: Wiley.
- M.H. Hyun (2012). 8.13 Chromatografické separácie a analýza: Chirálna chirálna stacionárna fáza založená. Editor: Erick M. Carreira, Hisashi Yamamoto. Pochopenie chirality. Elsevier. Strany 263-285. ISBN 9780080951683,
- Nguyen, L. Do., On, h., & Pham-huy, C. (2006). Chirálne lieky: Prehľad. International Journal of Biomedical Science: IJBS, 2(2), 85-100.

