Súdržnosť
- 2706
- 1
- Blažej Hrmo
Čo sú kohézné sily?
Ten súdržné sily Sú to sily medzimolekulárnej príťažlivosti, ktoré udržiavajú niektoré molekuly s inými. V závislosti od intenzity súdržných síl je látka v pevnom, kvapalnom alebo plynnom stave. Hodnota súdržných síl je vnútornou vlastnosťou každej látky.
Táto vlastnosť súvisí s tvarom a štruktúrou molekúl každej látky. Dôležitou charakteristikou kohéznych síl je to, že sa rýchlo znižujú, keď sa vzdialenosť zvyšuje. Potom sa nazývajú súdržné sily k príťažlivým silám, ktoré sa vyskytujú medzi molekulami tej istej látky.
Ten Odpudenie Sú to tie, ktoré sú výsledkom kinetickej energie (energia v dôsledku pohybu) častíc. Táto energia spôsobuje, že molekuly sú neustále v pohybe. Intenzita tohto pohybu je priamo úmerná teplote, pri ktorej je látka.
Aby sme spôsobili zmenu stavu látky, je potrebné zvýšiť svoju teplotu pomocou prenosu tepla. To spôsobuje zvýšenie odpudzovacích síl látky, ktoré, ak je to možné, môže skončiť za predpokladu zmeny štátu.
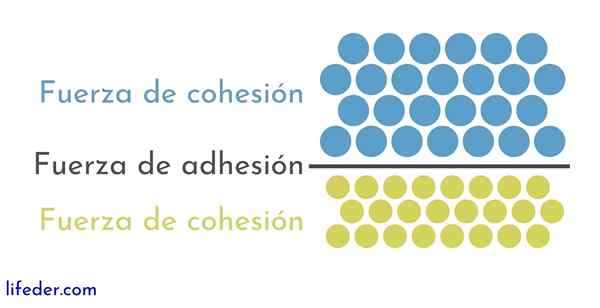
Na druhej strane je dôležité a potrebné rozlišovať medzi súdržnosť a adhézia:
- Kohézia je spôsobená príťažlivými silami medzi susednými časticami tej istej látky.
- Adhézia je výsledkom interakcie, ktorá sa vyskytuje medzi povrchmi rôznych látok alebo telies.
Tieto dve sily sa zdajú súvisieť s niekoľkými fyzikálnymi javmi, ktoré ovplyvňujú tekutiny, takže je dôležité dobré porozumieť jednému aj druhému.
Môže vám slúžiť: Vy Canis Majoris: Objav, charakteristiky, štruktúra, školenie a vývojSúdržné sily v tuhých látkach, kvapalinách a plynoch
 Atómy v troch hlavných stavoch hmoty
Atómy v troch hlavných stavoch hmoty V tuhých látkach
Všeobecne sú v tuhých kohéznych silách veľmi vysoké a sú intenzívne podávané v troch smeroch priestoru.
Týmto spôsobom, ak sa na tuhé telo aplikuje vonkajšia sila.
Okrem toho, keď vonkajšia sila zmizne, súdržné sily sú dostatočne silné na to, aby sa vrátili k molekulám v pôvodnej polohe a obnovili pozíciu pred použitím sily.
V kvapalinách
Naopak, v kvapalinách sú kohézne sily vysoké iba v dvoch smeroch priestorov, zatiaľ čo sú veľmi slabé medzi tekutými vrstvami.
Ak sa teda sila aplikuje v tangenciálnom smere na kvapalinu, táto sila prelomí slabé väzby medzi vrstvami. To spôsobí, že kvapalné vrstvy prechádzajú cez druhú.
Potom, keď uplatňuje použitie sily, súdržné sily nemajú dostatok sily na opätovné nastavenie tekutých molekúl v pôvodnej polohe.
Okrem toho sa v kvapalinách súdržnosť odráža aj v povrchovom napätí, spôsobená nevyváženou silou nasmerovanou na vnútornú stranu kvapaliny, ktorá pôsobí na povrchové molekuly.
Podobne sa pozoruje aj súdržnosť, keď je uvedený prechod z kvapalného stavu do tuhého stavu, v dôsledku účinku kompresie molekúl kvapalných kvapalín.
V plynoch
V plynoch sú súdržné sily opovrhnutiahodné. Týmto spôsobom sú molekuly plynu v neustálom pohybe, pretože v ich prípade ich súdržné sily nedokážu udržať navzájom spojené.
Môže vám slúžiť: Mechanická výhoda: vzorec, rovnice, výpočet a príkladyPreto v plynoch sú kohézne sily viditeľné iba vtedy, keď dôjde k procesu skvapalnenia, ku ktorému dôjde, keď sú plynné molekuly stlačené a sily príťažlivosti sú dostatočne silné na to, aby sa dosiahol prechod štátneho plynného k tekutine.
Príklady súdržných síl
Kohézné sily sa často kombinujú s adhéznymi silami, aby sa vznikli určitým fyzikálnym a chemickým javom.
Napríklad súdržné sily spolu s priľnavosťou umožňujú vysvetliť niektoré z najbežnejších javov, ktoré sa vyskytujú v kvapalinách; Toto je prípad menisku, povrchového napätia a kapilarity.
Preto je v prípade kvapaliny potrebné rozlišovať medzi kohéznými silami, ktoré sa vyskytujú medzi molekulami tej istej kvapaliny; a priľnavosť, ktoré sa vyskytujú medzi molekulami kvapaliny a tuhej látky.
Povrchové napätie

Povrchové napätie je sila, ktorá sa vyskytuje tangenciálne a na jednotku dĺžky na okraji voľného povrchu kvapaliny, ktorá je v rovnováhe. Táto sila stiahne povrch kvapalného povrchu.
Nakoniec sa vyskytuje povrchové napätie, pretože sily, ktoré sa vyskytujú v tekutých molekulách.
Menisku
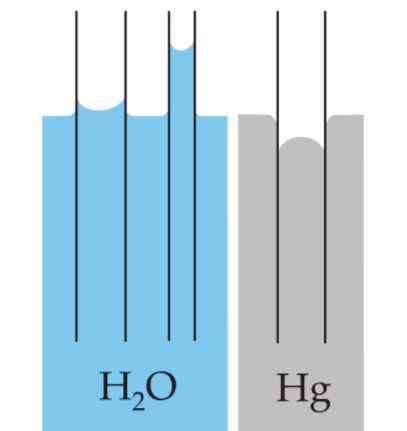
Zakrivenie, ktoré sa vytvára na povrchu tekutín. Táto krivka sa vytvára účinkom, ktorý má povrch nádoby na kvapalinu, ktorá ju obsahuje.
Môže vám slúžiť: tlakové metreKrivka môže byť konvexná alebo konkávna v závislosti od toho, či sila medzi molekulami kvapaliny a nádobou je príťažlivej - ako je to v prípade vody a skla - alebo sú odporu, ako je to v prípade ortuti a skla.
Kapitarita
 Príklad kapilarity
Príklad kapilarity Kapilarita je vlastnosť tekutín, ktorá im umožňuje vystúpiť alebo zostúpiť cez kapilárnu trubicu. Je to vlastnosť, ktorá čiastočne umožňuje vzostup vody vo vnútri rastlín.
Kvapalina stúpa cez kapilárnu trubicu, keď sú kohézne sily nižšie ako priľnavosť medzi tekutinou a stenami trubice. Týmto spôsobom bude kvapalina naďalej stúpať, až kým sa hodnota povrchového napätia rovná hmotnosti kvapaliny obsiahnutej v kapilárnej trubici.
Naopak, ak sú súdržné sily vyššie ako sily pri adhézii, povrchové napätie zostúpi do kvapaliny a tvar jeho povrchu bude konvexný.
Odkazy
- Súdržnosť (chémia) (n.d.). Na Wikipédii. Získaný z.Wikipedia.orgán.
- Povrchové napätie (n.d.). Na Wikipédii. Získaný z.Wikipedia.orgán.
- Kapileta (n.d.). Na Wikipédii. Zotavené z es.Wikipedia.orgán.
- Irán. Levine; „Fyzikálna chémia“ Zväzok 1; Piate vydanie; 2004; Hillm MC Graw.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chémia: Molekulárna veda. Belmont, CA: Brooks/Cole.
- Biele, Harvey a. (1948). Fyzika modernej vysokej školy. Van Nostrand.


