Krivka vykurovania Čo je, ako to robí, príklady

- 3508
- 757
- Blažej Hrmo
A Vykurovacia krivka Je to grafické znázornenie toho, ako sa teplota vzorky mení ako funkcia času, udržiava konštantný tlak a rovnomerne pridáva teplo, to znamená konštantnou rýchlosťou.
Na zostavenie takéhoto grafu sa odoberajú páry teploty a časových hodnôt, ktoré následne grafujú teplotu na vertikálnej osi (objednanej) a čas na horizontálnej osi (Abscissa).
 postava 1. Krivka zahrievania látky sa získa pridaním tepla a meraním teploty každú určitú dobu intervalu. Zdroj: Pixabay.
postava 1. Krivka zahrievania látky sa získa pridaním tepla a meraním teploty každú určitú dobu intervalu. Zdroj: Pixabay. Potom je najvhodnejšia krivka pre tieto experimentálne body upravená a nakoniec sa graf teploty T získa ako funkcia času t: t (t).
[TOC]
Aká je krivka vykurovania?
Keď sa zahrieva, látka prechádza postupne rozmanitými stavmi: Byť pevná sa môže naparovať, takmer vždy prechádza tekutým stavom. Tieto procesy sa nazývajú zmeny stavu, v ktorých vzorka zvyšuje svoju vnútornú energiu pri pridávaní tepla, ako je naznačené molekulárnou kinetickou teóriou.
Pridaním tepla do vzorky existujú dve možnosti:
- Látka zvyšuje svoju teplotu vzhľadom na skutočnosť, že jej častice sa miešajú s väčšou intenzitou.
- Materiál prechádza fázovou zmenou, v ktorej teplota zostáva konštantná. Pridajte teplo, ktoré má do istej miery oslabenie sily, ktoré udržiavajú kohézne častice, takže je ľahké prejsť z ľadu do kvapalnej vody, napríklad z ľadu do kvapalnej vody.
Obrázok 2 zobrazuje štyri stavy hmoty: tuhá látka, kvapalina, plyn a plazma a názvy procesov, ktoré umožňujú prechod medzi sebou. Šípky označujú význam procesu.
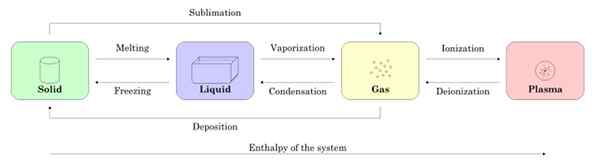 Obrázok 2. Štáty subjektu a procesy potrebné na prejsť medzi jedným a druhým. Zdroj: Wikimedia Commons.
Obrázok 2. Štáty subjektu a procesy potrebné na prejsť medzi jedným a druhým. Zdroj: Wikimedia Commons. -Zmeny stavu v látke
Počnúc vzorkou v tuhom stave, keď topenie prechádza do tekutého stavu, keď sa odparuje, stáva sa plyn a prostredníctvom ionizácie sa stáva plazmou.
Môže vám slúžiť: magnetické vlastnosti materiálovTuhá látka sa môže priamo stať plynom procesom známym ako sublimácia. Existujú látky, ktoré sa pri izbovej teplote ľahko podplákajú. Najznámejší je CO2 alebo suchý ľad, ako aj naftalén a jód.
Zatiaľ čo vzorka prechádza zmenou stavu, teplota zostáva konštantná, až kým nedosiahne nový stav. To znamená, že ak napríklad existuje časť kvapalnej vody, ktorá dosiahla svoj bod varu, jej teplota zostáva konštantná, až kým sa všetka voda nestane parou.
Z tohto dôvodu sa očakáva, že krivka vykurovania bude zložená z kombinácie rastúcich sekcií a horizontálnych rezov, kde posledne menovaná zodpovedá zmenám fázy. Obrázok 3 zobrazuje jednu z týchto kriviek pre danú látku.
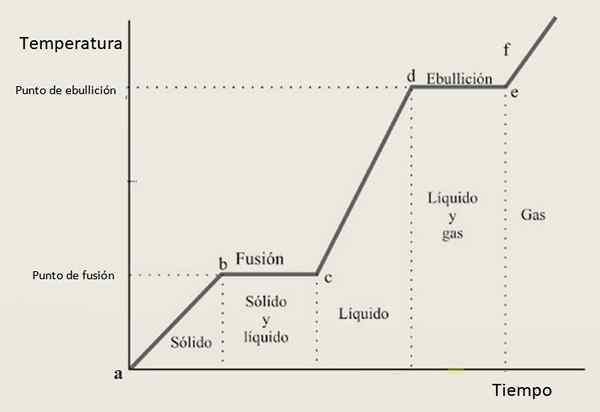 Obrázok 3. Krivka zahrievania danej látky, s typickou konfiguráciou založenou na krokoch a svahoch.
Obrázok 3. Krivka zahrievania danej látky, s typickou konfiguráciou založenou na krokoch a svahoch. Interpretácia krivky vykurovania
V intervaloch rastu AB, CD a Ef Látka sa nachádza ako pevná, kvapalná a plyn. V týchto oblastiach sa zvyšuje kinetická energia as ňou teplota.
Medzitým Bc Jeho stav z pevnej k tekutine sa mení, preto spolu existujú dve fázy. Toto je prípad v sekcii z, v ktorej vzorka prechádza z plynovej tekutiny. Tu mení potenciálnu energiu a teplota zostáva konštantná.
Inverzný postup je tiež možný, to znamená, že vzorka sa dá ochladiť tak, aby prijala postupne v iných štátoch. V tomto prípade sa hovorí chladič.
Vykurovacie krivky majú rovnaký všeobecný aspekt pre všetky látky, aj keď samozrejme nie rovnaké číselné hodnoty. Niektoré látky vyžadujú viac času ako iné, aby sa zmenil stav a roztavil sa a odparoval sa pri rôznych teplotách.
Tieto body sú známe ako bod topenia a bod varu a sú charakteristikami každej látky.
Môže vám slúžiť: ploché zrkadlá: rovnica, správanie, grafikaZ tohto dôvodu sú krivky zahrievania veľmi užitočné, pretože označujú číselnú hodnotu týchto teplôt pre milióny látok, ktoré existujú ako tuhé látky a kvapaliny v rozsahu teploty považovaných za normálne a pri atmosférickom tlaku.
Ako sa vyrába vykurovacia krivka?
V zásade je to veľmi jednoduché: stačí umiestniť vzorku látky do nádoby vybavenej miešadlom, zaviesť teplomer a rovnomerne zahriať.
Súčasne sa na začiatku procedúry aktivujú stopky a zaznamenávajú sa zodpovedajúce páry teploty času.
Zdroj tepla môže byť plynným zapaľovačom, s dobrou rýchlosťou zahrievania alebo elektrickým odporom, ktorý pri teplote tepla, ktorý sa môže pripojiť k premenlivému zdroju, aby získal rôzne právomoci.
Pre presnosť sú v chémiovom laboratóriu široko používané dve techniky:
- Diferenciálna tepelná analýza.
- Diferenciálna kalómetria.
Porovnávajú teplotný rozdiel medzi vzorkou študovanou a ďalšou referenčnou vzorkou s vysokou teplotou topenia, takmer vždy oxidom hliníka. Tieto metódy sa snažia ľahko nájsť body fúzie a varu.
Príklady (voda, železo ...)
Zvážte vykurovacie krivky pre vodu a železo znázornené na obrázku. Časová stupnica nie je znázornená, je však okamžitá.
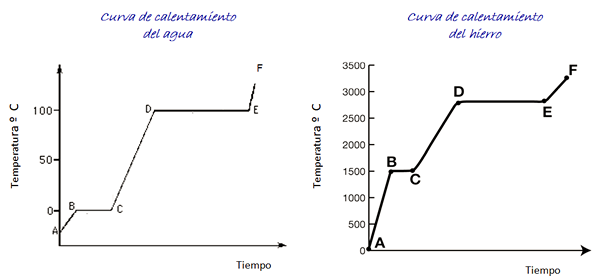 Obrázok 4. Krivky na zahrievanie vody a železa.
Obrázok 4. Krivky na zahrievanie vody a železa. Voda je univerzálna látka a teplotný rozsah potrebný na to, aby sa v laboratóriu dosiahli jeho zmeny stavu, je ľahké dosiahnuť. Pre železo sú potrebné oveľa vyššie teploty, ale ako je uvedené vyššie, tvar grafu sa podstatne nemení.
Môže vám slúžiť: Steinerova veta: Vysvetlenie, aplikácie, cvičeniaTopiaci sa ľad
Pri zahrievaní vzorky ľadu, podľa grafu sme v bode A, pri teplote pod 0 ° C. Zistilo sa, že teplota sa zvyšuje konštantnou rýchlosťou, kým nedosiahne 0 ° C.
Molekuly vody vo vnútri ľadu vibrujú väčšiu šírku. Po dosiahnutí teploty topenia (bod B) sa molekuly môžu už pohybovať pred inou.
Energia, ktorá prichádza, sa investuje do znižovania sily príťažlivosti medzi molekulami, takže teplota medzi B a C zostáva konštantná pre všetky ľad.
Premieňajte vodu na paru
Akonáhle je voda úplne v kvapalnom stave, vibrácie molekúl sa opäť zvyšujú a teplota sa rýchlo zvyšuje medzi C a D do bodu varu o 100 ° C o 100 ° C. Medzi d a e teplota zostáva v tejto hodnote, zatiaľ čo energia, ktorá prichádza, je zodpovedná za všetku vodu v nádobe na odparovanie.
Ak je všetka vodná pary obsiahnutá v nádobe, môže sa pokračovať v bode E do bodu F, ktorého limit nie je uvedený v grafike.
Vzorka železa môže prekročiť rovnaké zmeny. Vzhľadom na povahu materiálu sa však rozsah teploty veľmi líši.
Odkazy
- Atkins, str. Princípy chémie: Cesty objavovania. PAN -AMERICKÝ ZDROJE. 219-221.
- Chung, P. Vykurovacie krivky. Získané z: Chem.Librettexts.orgán.
- Vykurovacie krivky. Teplo fúzie a odparovania. Obnovené z: wikipremed.com.
- Hewitt, Paul. 2012. Koncepčná fyzická veda. 5. Edimatizovať. Pearson. 174-180.
- University of Valladolid. Titul chémie, získaný od: ubytovania.hitva.je.
- « Fázy cyklu Carnot, aplikácie, príklady, cvičenia
- Bromokresol zelené charakteristiky, príprava, použitia »

